Viagra gibt es mittlerweile nicht nur als Original, sondern auch in Form von Generika. Diese enthalten denselben Wirkstoff Sildenafil. Patienten suchen deshalb nach viagra generika schweiz, um ein günstigeres Präparat zu finden. Unterschiede bestehen oft nur in Verpackung und Preis.
Microsoft word - uso de antimicrobianos en animales de consumo2004new.doc

162 ISSN 1014-1200
FAO PRODUCCIÓN Y SANIDAD ANIMAL
USO DE ANTIMICROBIANOS
EN ANIMALES DE CONSUMO
incidencia del desarrollo de resistencias en salud pública
FAO PRODUCCIÓN Y SANIDAD ANIMAL
USO DE ANTIMICROBIANOSEN ANIMALES DE CONSUMO
incidencia del desarrollo de resistencias en salud pública
J. O. Errecalde
Facultad de Ciencias Veterinarias,
Universidad Nacional de La Plata, Argentina
ORGANIZACIÓN DE LAS NACIONES UNIDAS PARA LA AGRICULTURA Y LA ALIMENTACIÓN
Las denominaciones empleadas en esta publicación y la forma en que aparecen presentados los datos que contiene no implican, de parte de la Organización de las Naciones Unidas para la Agricultura y la Alimentación, juicio alguno sobre la condición jurídica o nivel de desarrollo de países, territorios, ciudades o zonas, o de sus autoridades, ni respecto de la delimitación de sus fronteras o límites.
ISBN 92-5-305150-7
FAO 2004
1. Introducción
2. Los antibióticos, su descubrimiento, desarrollo, historia,
aparición de las primeras resistencias
3. La toxicidad selectiva, base de la quimioterapia
4. La era de los antimicrobianos y de las resistencias
¿Cuáles son los mecanismos de acción de los antibióticos?
6. Pruebas de laboratorio versus tratamientos a ciegas
¿Cuáles son y qué nos proveen las pruebas de susceptibilidad
antimicrobiana?
8. Criterios de susceptibilidad y resistencia
9. La evolución de la metodología analítica
10. Concentraciones de residuos y su interpretación intuitiva
11. Las ingestas diarias aceptables y los límites máximos de residuos 18 12. ¿Cuáles son los riesgos de la presencia de antimicrobianos en
13. La resistencia a los antimicrobianos, sus mecanismos y epidemiología
13.1 Las resistencias cromosómicas
13.2 Las resistencias transferibles
13.3 Los mecanismos de transferencia de resistencias pueden clasificarse en:
13.4 ¿Cuáles son los mecanismos de resistencia?
13.5 Bacterias resistentes en medicina veterinaria
13.6 Las bacterias resistentes en la población humana
13.7 La llegada de las bacterias animales a la población humana 30
14. Formas de uso antibiótico en medicina veterinaria
15. El mal uso de antimicrobianos y el desarrollo de resistencias
15.1 Causas del mal uso de antimicrobianos y su vinculación con la generación de bacterias resistentes
15.2 Uso de antimicrobianos en el hombre
16. El uso racional de los antimicrobianos
16.1 La terapia por encima de la concentración inhibitoria
16.2 Curvas de muerte bacteriana y efectos persistentes de los
16.3 Parámetros farmacocinéticos
16.4 Parámetros farmacocinético-farmacodinámicos
16.5 Tipos de drogas antimicrobianas a la luz de los nuevos conocimientos
16.6 Utilización de los parámetros farmacocinético-farmacodinámicos para evitar la emergencia de resistencias
17. Los costos de la resistencia en medicina humana y veterinaria
18. Análisis de riesgos y control de puntos críticos, una nueva herramienta
19. ¿Hacia dónde va la resistencia bacteriana?
20. ¿Se debe suspender el uso de antimicrobianos como promotores del crecimiento?
21. ¿Existen alternativas al uso de antibióticos como promotores del crecimiento?
22. La higiene como barrera para la prevención de la diseminación de resistencias
Uso de antimicrobianos en animales de consumo
USO DE ANTIMICROBIANOS EN ANIMALES DE
INCIDENCIA DEL DESARROLLO DE
RESISTENCIAS EN LA SALUD PÚBLICA
Jorge O. Errecalde
Médico Veterinario. Médico
Profesor Titular, Cátedra de Farmacología, Farmacotecnia y Terapéutica
Facultad de Ciencias Veterinarias, Universidad Nacional de La Plata
1. Introducción
Los antimicrobianos son sustancias que se obtienen por síntesis o naturalmente a partir de los cultivos de microorganismos. Mediante modificaciones de la estructura química de un agente obtenido naturalmente, es posible producir agentes semisintéticos.
Los agentes del grupo de los colorantes fueron los primeros agentes
sintéticos utilizados. En virtud de evoluciones posteriores, estos agentes dieron origen a las sulfamidas. Algunos agentes inicialmente naturales como el cloranfenicol fueron sintetizados más tarde, y ello permitió abaratar considerablemente sus costos de producción. Otros agentes sintéticos de uso frecuente en la actualidad son los nitrofuranos y las quinolonas.
El primer antibiótico natural fue la penicilina, que es el ejemplo
excluyente, al representar el primer escalón de un grupo enorme de drogas de gran actividad y uso extendido y el inicio de una nueva etapa en la historia de la humanidad. A partir de la molécula de la penicilina se semisintetizaron muchos otros agentes, en la búsqueda de mejorar ciertas características que parecían deficitarias del antibiótico original. Así aparecieron las penicilinas ácido-resistentes, que se pueden administrar oralmente sin ser inactivadas por el ácido gástrico de los animales monogástricos y del hombre, como la penicilina V. También aparecieron las penicilinas penicilinasa resistentes, con capacidad de resistir el ataque de bacterias resistentes, productoras de enzimas que pueden inactivar la molécula madre, como es el caso de cloxacilina y meticilina. Se actuó, además sobre el espectro, que en el caso de la penicilina es relativamente estrecho. Así aparecieron ampicilina y amoxicilina, por ejemplo, drogas que son capaces de actuar sobre una variedad de bacterias sustancialmente mayor que la penicilina. A través de otras modificaciones entraron en escena las penicilinas activas frente a
Uso de antimicrobianos en animales de consumo
Pseudomonas aeruginosa, una bacteria que representó siempre una amenaza para la salud pública y animal, siendo la carbenicilina el mejor ejemplo. Combinándose la molécula madre con diferentes sales, surgieron las penicilinas procaínicas y benzatínicas, que, como característica saliente, se depositan en el sitio de administración y su lenta liberación da lugar a un perfil de acción prolongado; esto vino a aportar solución al hecho de que las penicilinas son drogas de semivida de eliminación corta (corta persistencia en el organismo), en relación a otros agentes antimicrobianos. Las cefalosporinas fueron otro capítulo de los beta lactámicos (en realidad se los debería llamar beta cefalosporámicos) y, actualmente, carbapenems y monobactams son los ejemplos más modernos de este grupo. Como ejemplo de los enormes cambios que se fueron generando en el terreno del descubrimiento de quimioterápicos, podemos mencionar que, entre los carbapenems, el imipenem es una de las drogas de más amplio espectro conocido. Lo paradojal de esto es que el grupo de antibióticos beta lactámicos fue conocido hasta no hace mucho tiempo como antibióticos de espectro reducido y, actualmente, incluye algunos de los agentes que lo tienen más amplio. Fuera del grupo de beta lactámicos, neomicina, macrólidos y tetraciclinas, entre otros, son ejemplos de agentes naturales.
2. Los antibióticos, su descubrimiento, desarrollo, historia,
aparición de las primeras resistencias
Lister y Pasteur Es un poco difícil definir cuándo comienza la historia de los antibióticos, o mejor aún, de los quimioterápicos. Sin embargo, podemos citar que en los primeros años del siglo XX, cuando Paul Ehrlich anunció la eficacia del salvarsán para el tratamiento de la sífilis, muchos pensaron que la lucha contra las enfermedades infecciosas había sido ganada. Lo promisorio de este hallazgo, sin embargo, no sirvió como estimulante de la investigación y el descubrimiento, ya que, en el año 1914 estalla la primera guerra y, durante seis largos años, las urgencias impiden que se piense en desarrollos futuros. Después de 1920, nuevamente se inicia el proceso creador y surgen novedades en el terreno de los protozoodicidas como la atebrina para el tratamiento del paludismo o de la triparsamida para el combate de la enfermedad del sueño.
Es interesante mencionar, como relata Iago Galdston (1943) que Calvin
Coolidge, hijo del trigésimo presidente de los Estados Unidos, murió el 7 de julio de 1924. La causa de su muerte fue una septicemia. Una semana antes el joven se había hecho una herida en el dedo de un pie. Parecía poco importante. Sin embargo, fue la puerta de entrada de su muerte, ya que, el
Uso de antimicrobianos en animales de consumo
martes se lesionó, el miércoles a la noche se quejó de fuertes dolores en la ingle, pensándose en apendicitis. Se llamaron especialistas que llegaron rápidamente al verdadero diagnóstico el día jueves: septicemia. Se luchó con todo y lo mejor para salvarlo, el sábado ingresó al hospital y fue operado de urgencia, todo fue en vano, el domingo empeoró y el lunes, murió. La muerte había triunfado, no había herramientas para la lucha.
Doce años después (1936), los diarios atraían al lector con una noticia:
Franklin Delano Roosvelt, hijo de otro presidente, estaba muy enfermo, infectado. Pero había más esperanzas, dado que se disponía de un medicamento capaz de matar microorganismos dentro de la corriente sanguínea. El joven se salvó. Así el público conoció el Prontosyl, la primera sulfamida. En 1935 Domagk había presentado su primera monografía sobre eficacia del Prontosyl.
En ese momento, alguien dijo, y con razón, que probablemente, el siglo
XX iba a ser conocido como el siglo de las sulfamidas. Ocurre que se ignoraba lo que desde hacía tiempo estaba ocurriendo en el Hospital St. Mary de Londres. Allí Alexander Fleming trabajaba duro, multiplicando diversas variedades de gérmenes causantes de infecciones supuradas. En el curso de su investigación, una fortuita observación, analizada con espíritu crítico y enorme base científica, produjo el inicio de un proceso que culminó con la obtención de la penicilina. Sin embargo no fue rápido el desarrollo y la adopción del nuevo medicamento. Al contrario, en los primeros años, Fleming no obtuvo eco en los ambientes médicos. Mientras él estudiaba el hongo, sus productos de secreción, sus estructuras químicas, la existencia del Atoxyl, Salvarsán y Prontosyl, entre otras sustancias, hacía pensar que todo estaba resuelto. Nadie prestaba atención al nuevo descubrimiento. Pasaron diez largos años, las sulfamidas no solamente habían demostrado su eficacia, sino que se conocía como actuaban, cosa que no ocurría con la penicilina.
En el año 1939 se produce un nuevo descubrimiento, René Dubos de la
Fundación Rockefeller, investigando los gérmenes del suelo, descubre la Tirotricina. Era un producto del metabolismo del Bacillus brevis. Esta droga era extremadamente eficaz, pero muy tóxica. Solamente se la podía utilizar en tratamientos locales. Se trata de un hallazgo al que la historia no le dedica la enorme importancia que realmente tiene.
El descubrimiento de la tirotricina, un antibiótico, llevó la atención
nuevamente hacia la penicilina. Dado que la tirotricina era natural, obtenida por biosíntesis, de mecanismo de acción desconocido y poderosamente activa, aunque tóxica. Howard Florey, australiano que trabajaba en Oxford, retoma el trabajo de desarrollo de la penicilina. Demostrar nuevamente la eficacia y ahora la inocuidad de la penicilina fue la primera tarea, que fue muy compleja, especialmente por las pequeñas cantidades de droga de que se disponía y la poca pureza en que se encontraba. Los primeros éxitos clínicos
Uso de antimicrobianos en animales de consumo
fueron asombrosos, pese a algún fracaso inicial por falta de medicamento para completar el tratamiento.
Las bajas cantidades de penicilina eran la gran limitante. Se debió pasar
a una nueva etapa, la escala industrial en la elaboración del fármaco. Si bien a través de pasos sucesivos los cultivos del hongo se fueron haciendo más eficaces en la producción de la droga, el punto de inflexión se produjo cuando los investigadores descubrieron una nueva variedad del hongo que se podía cultivar en profundidad y eso permitió la utilización de grandes tanques de fermentación. Esto ocurría en los primeros años de la década del 40. La revolución de los antibióticos había comenzado.
En medicina veterinaria, paralelamente a lo que ocurría en medicina
humana, los antibióticos comenzaron a ser utilizados para tratamientos de animales enfermos, y cuando eso era considerado necesario, tratar animales asintomáticos que convivían con los enfermos, eso es tratamientos grupales profilácticos. Esto comenzaba a ocurrir en la década del 50.
En esa época, alimentando cerdos con desechos de fermentación de
tetraciclinas, se descubrió que esos cerdos crecían más que los que recibían otros alimentos. Al asociarse la respuesta lograda con el origen del alimento, se estaba descubriendo la capacidad de los antibióticos de contribuir al crecimiento de los animales, mejorando los índices de conversión, esto es, crecer más con la misma cantidad de alimento. Este es el inicio histórico del uso de antibióticos como promotores del crecimiento cuando son adicionados en cantidades subterapéuticas a los alimentos. Los grupos de antibióticos que, en general se utilizaban para este fin eran penicilinas y tetraciclinas. Algunos años más tarde, comenzó a surgir preocupación por la aparición de cepas resistentes a estos antibióticos de salmonellas aisladas de terneros con enfermedad respiratoria. Sin embargo la utilización de quimioterápicos como promotores del crecimiento, ha continuado hasta nuestros días con buenos resultados y generando una discusión, durante los últimos años, de la que nos ocuparemos en secciones posteriores.
3. La toxicidad selectiva, base de la quimioterapia
Las enormes diferencias que existen entre las células bacterianas y las células de los mamíferos, hacen que, en muchas oportunidades los blancos de los antimicrobianos en una bacteria, no existan en las células del hospedador o, en todo caso, que esos blancos sean suficientemente distintos como para que las diferencias en afinidad sean tan marcadas que expliquen la acción selectiva sobre la bacteria. En definitiva la célula bacteriana es procariota (carece de núcleo desarrollado), a diferencia de los protozoarios, hongos o las células de animales superiores. La penicilina, primer antibiótico de la historia, es, quizás, el más claro ejemplo de acción quimioterápica, dado que
Uso de antimicrobianos en animales de consumo
actúa sobre una estructura de la bacteria que no se encuentra en los eucariotes. Otros antimicrobianos, por su parte, no son tan perfectos en su actividad quimioterápica, dado que actúan sobre estructuras presentes en bacterias y animales superiores, aunque con mayor afinidad sobre los receptores bacterianos. Esto permitiría que, en estos casos, dosis elevadas del agente quimioterápico, generen algún tipo de toxicidad en el hospedador.
La quimioterapia antiparasitaria, por su parte, no es tan sencilla dado que
un parásito es un ser pluricelular (obviamente de células eucariotas), dotado de sistemas y aparatos, que funciona en forma extremadamente parecida a un animal superior. De esas finas diferencias depende la actividad selectiva de los antiparasitarios. El máximo desafío de la actividad quimioterápica está representado por la acción frente a neoplasias. Una neoplasia es un crecimiento de un grupo celular, en general altamente indiferenciado, que se desarrolla en forma independiente de las reglas generales del organismo, pero dentro y formando parte de él. Por lo tanto, actuar contra estas neoformaciones sin que la actividad tóxica se manifieste en contra del organismo todo, es extremadamente complejo.
4. La era de los antimicrobianos y de las resistencias
En la Sección 1 describimos como se inició la revolución de los antimicrobianos. Fue a partir, probablemente, de la tirotricina (algo muy poco mencionado), ya que esta droga sirvió para demostrar que una sustancia antibiótica (obtenida de un organismo vivo, a diferencia de las sulfas, sintéticas) era capaz de ser completamente eficaz frente a determinadas infecciones y pese a no conocerse fehacientemente su mecanismo de acción (el de las sulfas era bien conocido), logró impactar en la opinión médica. Como mencionáramos, su toxicidad era una limitante, pero esto sirvió para relanzar el desarrollo de la penicilina cuya toxicidad se suponía mucho más baja. En cuanto la inocuidad de esta última fue demostrada, su camino al éxito estuvo marcado.
En los años siguientes, comenzaron a descubrirse nuevas drogas. Se
transcriben algunos de los hallazgos más trascendentes: En la década del 40 estreptomicina, cloranfenicol y clortetraciclina. En la década del 50 eritromicina y vancomicina. En la del 60, gentamicina, ampicilina, cefalotina y amikacina. En la del 70, cefalexina, carbenicilina, cefoxitina y cefaclor. En la del 80, cefotaxima, moxalactam, combinación ácido clavulánico-amoxicilina, combinación imipenem-cilastatina, aztreonam. En los 90 aparecen las fluoroquinolonas, nuevos macrólidos, y nuevas cefalosporinas y agentes antivirales más efectivos. Luego del 2000 registramos la aparición de quinolonas de espectro ampliado.
Uso de antimicrobianos en animales de consumo
Por supuesto que todos estos descubrimientos estuvieron catalizados por
algo. Ese algo fue una mezcla de componentes compuesta por la inquietud de los investigadores y de la industria por una parte, pero innegablemente, la aparición de diversos niveles de resistencias bacterianas por el otro. Esto generó una competencia entre los microorganismos, generando resistencias y seleccionándose en pro de éstas y el hombre, por su parte, imaginando, diseñando, tamizando, en la búsqueda de nuevos compuestos más eficaces y más seguros para la lucha antimicrobiana. Si bien el hombre no cede en su lucha, los microorganismos tampoco, y estos últimos van sacando ventaja, lenta e inexorablemente.
El fenómeno de resistencia a la penicilina fue descubierto poco tiempo
después de su descubrimiento, sin embargo fue tomado más como una curiosidad que como un hecho clínico de trascendencia. Sin embargo, cuando en la década del 50 las resistencias a la penicilina adquieren peso clínico, se toma total conciencia del fenómeno. En los 60, los estafilococos meticilino-resistentes y Pseudomonas gentamicino-resistentes confirman la gravedad del cuadro. En los 70 las resistencias a ampicilina se hacen frecuentes. En los 90 aparecen cepas de enterococos resistentes a ampicilina y en el caso de M. tuberculosis, que ya presentaba variedades resistentes a algunos tuberculostáticos, aparecen cepas multirresistentes. Pese a la relatividad de los datos de resistencia, en la Tabla 1 se presentan, esquemáticamente los años de descubrimiento de los agentes antimicrobianos más importantes y los años en que las resistencias a los mismos fueron comunicadas. En la misma se puede apreciar en términos prácticos la velocidad de aparición de resistencias de importancia clínica. La comunicación de resistencia a cada antibiótico fue descripta mucho antes, pero, en todos los casos como hallazgos de laboratorio. Por cierto que a la luz de los conocimientos actuales se puede decir que ante la llegada de un nuevo antibiótico a la clínica, es muy probable que ya existan variedades bacterianas capaces de resistir a su acción, o que éstas aparezcan y se seleccionen con velocidad variable. Es esa velocidad variable la que se debe regular a través de la utilización racional de antimicrobianos, ya que, seguramente, no se podrá evitar su emergencia.
Actualmente existe una gran cantidad de antimicrobianos que han
aparecido en diferentes momentos de la historia, algunos, modernos, representan armas poderosas, otros, más antiguos, han caído en desuso. Sin embargo, penicilina, vancomicina, tetraciclinas, etc., siguen siendo antibióticos que, cuando utilizados racionalmente, y dejando de lado algunas cepas bacterianas resistentes, siguen exhibiendo la eficacia del momento de su descubrimiento. En la Tabla 2 se presenta una clasificación química de los diversos agentes antimicrobianos con algunos ejemplos salientes, conjuntamente con su modo de acción y espectro antimicrobiano.
Uso de antimicrobianos en animales de consumo
TABLA 1. Año de descubrimiento de los agentes antimicrobianos más
importantes y año de comunicación de la existencia de cepas
resistentes a los mismos.
Uso clínico
Resistencia clínica
Fluoroquinolonas 1978
Datos tomados de Ronald et al (1966), Kammer (1982), Davies (1997), O'Brien (1997), Soussy (1998), Weidermann & Heisig (1999). La utilización de antimicrobianos y antiinfecciosos en medicina veterinaria tiene tanta antigüedad como su uso médico. Además de su uso como agentes antiinfecciosos terapéuticos, se los ha usado como promotores del crecimiento, dado que a concentraciones subterapéuticas, por mecanismos no muy bien esclarecidos, son capaces de aumentar la conversión de alimento (un tema particularmente discutido actualmente, que se trata por separado en este trabajo). Hay además un grupo importante de agentes que se utilizan como anticoccidiales, pero que tienen actividad antibacteriana, entre los que encontramos ionóforos como la monensina, lasalocid y salinomicina, quinoxalinas, avilamicina, etc. Hay una serie de productos antibacterianos, en general conocidos como desinfectantes y antisépticos, que también comparten responsabilidad en el desarrollo de resistencias, especialmente por compartir algunos de los mecanismos de bombeo desde el soma bacteriano, desarrollados por algunas bacterias, con otros antibióticos. Incluso algunos metales, como el zinc y cobre que se suelen adicionar a alimentos animales, pueden seleccionar bacterias por su capacidad de bombeo hacia el exterior de diversos agentes.
5. ¿Cuáles son los mecanismos de acción de los antibióticos?
Los agentes antimicrobianos actúan por una serie de mecanismos, muy diferentes entre ellos y cuyos blancos se encuentran en diferentes regiones de la célula atacada. Las diversas regiones de ataque antibacteriano en general son consideradas:
• Pared bacteriana • Membrana bacteriana • Síntesis de proteínas • Síntesis de ácidos nucleicos
En la Figura 1 se presentan las drogas antibacterianas más comunes y sus lugares de acción dentro de la estructura microbiana. En la Tabla 2 se
Uso de antimicrobianos en animales de consumo
presenta una clasificación de los agentes antibióticos, algunos ejemplos de cada grupo, su modo de acción y un resumen de su espectro antimicrobiano. Las drogas que atacan la pared bacteriana ejercen su efecto a través del bloqueo de su síntesis. Interfieren con la síntesis de peptidoglicanos, elementos esenciales de la constitución de la pared. Los defectos de la pared celular llevan a la lisis bacteriana. Actúan solamente frente a microorganismos que están en crecimiento activo. Pertenecen a este grupo: Beta lactámicos, glucopéptidos (vancomicina, teicoplanina y avoparcina), bacitracina y estreptograminas (virginiamicina, quinupristina-dalfopristina). Los agentes activos en la membrana celular bacteriana son las polimixinas (polimixina B y colistín). Estas drogas son péptidos catiónicos con actividad de tipo detergente que disrumpen la porción fosfolipídica de la membrana de las bacterias Gram negativas.
Interfiriendo con la síntesis de proteínas, a diversos niveles del organoide
encargado de su elaboración, el ribosoma, actúa un cúmulo de agentes, a saber: Aminoglucósidos y aminociclitoles, tetraciclinas, cloranfenicol y sucedáneos, lincosamidas y macrólidos. Dada la complejidad de este proceso, hay diversos blancos que son impactados por los diferentes agentes antiinfecciosos. Los aminoglucósidos y aminociclitoles actúan a nivel de la porción 30 S del ribosoma, induciendo errores en la lectura de la información aportada por el ARN mensajero. De esta manera, la proteína que se sintetice contendrá errores y no será útil. También son capaces de inducir alteraciones de las membranas. Las tetraciclinas, por su parte, también se unen al ribosoma en la porción 30 S, en forma similar a lo que ocurre con los aminoglucósidos. Cloranfenicol, tianfenicol y florfenicol, actúan a nivel de la porción 50 S del ribosoma, inhibiendo la transpeptidasa, lo que impide que se formen los péptidos. Lincosamidas y macrólidos, también se unen a la porción 50 S, inhibiendo la traslocación. Todos estos mecanismos, de una u otra manera, detienen o desvían la síntesis de proteínas.
Los agentes que actúan a nivel de los ácidos nucleicos son varios y sus
sitios de acción diversos. Entre ellos tenemos a las sulfamidas y trimetoprima cuya acción como antimetabolitos impidiendo la síntesis de purinas los distingue del resto. Las fluoroquinolonas y novobiocina actúan a nivel de las cadenas de ADN, impidiendo el superenrrollamiento, por inhibición de una topoisomerasa, la girasa de ADN. Los nitroimidazoles, como dimetridazol, metronidazol y tinidazol dan lugar a la disrupción de las cadenas de ADN, impidiendo su reparación. Los nitrofuranos, por su parte impiden la lectura codónica ADN-ARN mensajero.
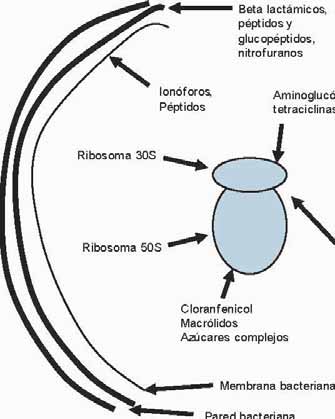
Uso de antimicrobianos en animales de consumo
Figura 1: Esquema de estructuras bacterianas que incluye pared, membrana, ribosoma y
ácidos nucléicos, conjuntamente con algunos ejemplos de antimicrobiamos que actúan a esos
niveles.
Uso de antimicrobianos en animales de consumo
TABLA 2. Clasificación química de los antimicrobianos, algunos
ejemplos, modo de acción y espectro simplificados
Miembros
Modo de acción
Espectro
Beta lactámicos:
inhiben síntesis de pared
Penicilinas
Penicilina
Estafilococos productores de penicilinasa
Beta lactámicos:
Bacterias G+ y G-
Inhiben síntesis de pared
actividad frente a Estafilococos productores de penicilinasa
Ídem con menos actividad frente a G+ y más frente a G-
Moxalactam Ídem
Cefoperazona Ídem
Pseudomonas aeruginosa
Beta lactámicos:
Se une a la beta lactamasa
Inhibidores de
la Beta lactamasa
Beta lactámicos:
Inhiben síntesis de pared
G+ y G- aerobios
Carbapenems
Beta lactámicos:
Monobactams
Estreptomicina Inhiben
porción 30 S ribosomal
Gentamicina Idem
Espectinomicina Idem
Uso de antimicrobianos en animales de consumo
TABLA 2 (Continuación)
Grupo
Miembros
Modo de acción
Espectro
Azúcares complejos o
Lincomicina Inhiben
porción 50S ribosomal
anaerobios y micoplasmas
Clindamicina Ídem
Pirlimicina Idem
Rifamicinas
Inhib e ARN polimerasa
positivas micobacterias
Péptidos
Desorganizan membrana
Pseudomonas aeruginosa
Inhibe síntesis de pared
Bacterias G+ y G-
Teicoplanina Idem
Inhibe peptidil transferasa
Bacterias G+ aerobias y anaerobias
Macrólidos
Inhibe síntesis proteica porción
Bacterias G+ y G-
Oleandomicina Idem
Espiramicina Idem
Tilmicosina Idem
Fenicoles
Inhibe síntesis proteica porción
Bacterias G+ y G-
rickettsias y chlamydias
Tianfenicol Idem
Florfenicol Idem
Inhibe síntesis proteica porción
Bacterias G+ y G-
, Rickettsias, chlamydias y algunos protozoos
Doxiciclina Idem
Minociclina Idem
Interfieren síntesis de ácido
Bacterias G+, G-
Sulfadiazina Idem
Sulfatiazol Idem
Ftalilsulfatiazol Idem
Interfieren síntesis de ácido
Bacterias G+, G-
tetrahidrofólico
Baquiloprima Idem
Enrofloxacina Inhiben
positivas y Gram negativas
Danofloxacina Idem
Uso de antimicrobianos en animales de consumo
TABLA 2 (Continuación)
Grupo
Miembros
Modo de acción
Espectro
Marbofloxacina Idem
Sarafloxacina Idem
Ionóforos
Alteran flujo de membrana
Coccidiosis, promoción del crecimiento
Salinomicina Idem
Previenen traslación ARN
positivas y Gram negativas
Furazolidona Idem
Metronidazol Disrupción
Dimetridazol Idem
6. Pruebas de laboratorio versus tratamientos a ciegas
Se trata de un tema extremadamente conflictivo. Frente a la instauración de una terapia antimicrobiana, tenemos dos alternativas: por un lado el aislamiento, identificación y prueba de susceptibilidad del/los gérmenes actuantes, y por el otro, el tratamiento a ciegas (que como veremos más adelante no es algo malo si se lo hace con el criterio necesario).
En el caso de disponer de pruebas de laboratorio, saber de qué
microorganismo se trata, a qué antibiótico es susceptible, y aún más, cuál es la concentración inhibitoria mínima para el agente que se está pensando seleccionar para el tratamiento, representan innegablemente, enormes ventajas. Pero lejos de ser la solución del problema, solamente sirven para ayudar en el diseño del plan terapéutico adecuado.
En una prueba de laboratorio, el microorganismo es colocado en
condiciones de crecimiento óptimo, el mejor pH, la temperatura ideal, los nutrientes necesarios, en un medio apacible para él, como es la placa de Petri (esto a los efectos de obtener un rápido crecimiento, aunque esto lo aleje de las condiciones que se encuentran en el organismo). Comparemos lo que ocurre, por ejemplo, a un estafilococo en condiciones de laboratorio, con lo que ocurre con el mismo microorganismo dentro de un fagolisosoma de un macrófago, donde, luego de ser fagocitado, se encuentra en condiciones de pH y ataque enzimático que no tienen nada que ver con las anteriores, al punto que su metabolismo como mecanismo de defensa- baja hasta la etapa de "sueño bacteriano" y su reproducción se encuentra inhibida. Consideremos que una bacteria que está en pleno proceso reproductivo es muy susceptible a bactericidas como los beta-lactámicos y que una bacteria "dormida", definitivamente no lo es a las concentraciones y tiempos de contacto habituales en tratamientos convencionales. Esto pone a las pruebas de susceptibilidad antimicrobiana en un lugar difícil.
Uso de antimicrobianos en animales de consumo
Parece evidente que una prueba de susceptibilidad por sí misma no es suficiente, y que estas pruebas deben combinarse con parámetros farmacocinéticos para, de acuerdo con el estado actual del conocimiento, obtener los mejores resultados posibles. Sobre este tema nos extenderemos más adelante, cuando hablemos de la relación farmacocinética farmacodinamia.
Si no tenemos resultados de laboratorio para hacer un tratamiento
antimicrobiano, las cosas cambian respecto de lo anteriormente descripto. Estamos en franca inferioridad de condiciones. Sin embargo, eso no significa que, sin resultados de laboratorio, un tratamiento deba ser, necesariamente irracional. Antes de aplicar el medicamento habrá que considerar: ¿Cuál es la sintomatología clínica? ¿Cuál es el foco infeccioso? ¿Qué nos indica la historia del establecimiento en cuanto a frecuencia de infecciones con esa sintomatología en esa especie animal? ¿Disponemos de pruebas de laboratorio previas? ¿Qué datos existen en los registros del establecimiento? ¿Cuáles son los datos que aporta la persona a cargo de los animales? ¿Existe una posibilidad concreta de presencia de flora mixta? ¿Cuál es la historia de uso de antimicrobianos en el establecimiento? ¿Sus éxitos? ¿Sus fracasos? ¿El o los animales enfermos son inmunocompetentes? ¿Existe otra patología concomitante? ¿Se está llevando a cabo alguna otra terapia concomitantemente? Estas son solamente algunas de las preguntas que el profesional actuante necesariamente deberá hacerse antes de pensar en la elección de un agente antimicrobiano, su dosis, esquema de dosificación y tiempo de tratamiento.
Si la terapia no puede basarse en pruebas de laboratorio (y esto es algo
que muy frecuentemente ocurre en diversas regiones del mundo), el criterio clínico se vuelve esencial y, combinado con el conocimiento de las características farmacocinéticas y farmacodinámicas del medicamento elegido, pueden conducir al éxito terapéutico.
7. ¿Cuáles son y qué proveen las pruebas de susceptibilidad
antimicrobiana?
Los métodos de determinación de susceptibilidad antimicrobiana han sido una inquietud desde el inicio de la era antibiótica. Sin embargo, aún hoy no se considera que exista la metodología ideal. Como se desarrolló parcialmente en la sección anterior, las pruebas de que disponemos no son perfectas, pero indiscutiblemente, nos pueden proveer de una buena ayuda.
Los resultados de los tests de susceptibilidad bacteriana guían al
veterinario en la elección del tratamiento adecuado. Esos tests se basan en descripciones hechas por el National Comitee for Clinical Laboratory Standards (NCCLS), que fueron desarrolladas para aplicación en medicina humana, y aún hoy son utilizadas por muchos laboratorios de diagnóstico
Uso de antimicrobianos en animales de consumo
veterinario. Algunos de estos métodos son utilizados sin su debida validación para el patógeno veterinario estudiado, por lo que han sido criticados como posiblemente inapropiados e incluso contradictorios (Watts & Yancey, 1994).
La prueba más difundida por su simplicidad y economía es la de difusión
en discos de papel. Estos discos son preparados comercialmente en forma totalmente estandarizada con las concentraciones de principio activo necesarias. Los discos son colocados sobre la superficie de agar de una placa de Petri, que ha sido previamente inoculada con una cantidad estandarizada del germen cuya susceptibilidad se desea medir (es una cantidad que oscila
aproximadamente en las 10 unidades formadoras de colonias por mililitro de inóculo). Una vez completado este proceso, la placa se coloca en estufa de cultivo y comienza, por un lado, el crecimiento de la bacteria y, por el otro, la difusión del antibiótico desde el disco de papel. El antibiótico se aleja del disco según un gradiente de dilución, de modo que, a mayor distancia, menor concentración. Esto da lugar a que, a determinada distancia del disco de papel la dilución del antibiótico no alcance a inhibir el crecimiento de la bacteria y se forme un halo de inhibición circular, cuyo diámetro será directamente proporcional a la potencia del antibacteriano frente a la bacteria en cuestión e inversamente proporcional a la concentración inhibitoria mínima (CIM) del agente antimicrobiano.
Este tipo de prueba nos da como resultado, un diámetro de halo de
inhibición. Este es un resultado cualitativo, es decir, germen susceptible o resistente, o en el mejor de los casos un resultado semi-cuantitativo, que nos dirá si el germen es susceptible, medianamente susceptible o resistente. Actualmente se dispone en forma experimental de sistemas computarizados que determinan la CIM de un determinado agente a partir del halo de inhibición. Para su funcionamiento estos sistemas requieren una enorme base de datos. En medicina humana este sistema está dando buenos resultados. En medicina veterinaria se trabaja en su implementación.
La prueba de dilución en tubos sigue siendo la más usada y probada para
la obtención de información cuantitativa. El fundamento de la técnica es
extremadamente sencillo, utilizándose una dilución de 5x10 bacterias por mL de caldo en cada tubo. Cada uno de los tubos es inoculado con una cantidad creciente del antibiótico a controlar. La batería de tubos es incubada por un período de tiempo de unas, 15 a 20 horas a 35 grados centígrados, para finalmente interpretarse como CIM la más baja concentración capaz de inhibir el crecimiento bacteriano, es decir, aquella presente en el primer tubo que no se opaca por acción del desarrollo de los microorganismos.
Hasta aquí lo clásicamente conocido. Han aparecido, además, sistemas
más modernos. Entre ellos, encontramos el E-Test, éste se basa en la determinación de la CIM en tiritas que portan un gradiente de concentración a su largo. Se trata de una prueba sencilla que aporta información mucho más
Uso de antimicrobianos en animales de consumo
valiosa que la de discos de papel, en que sólo una o pocas concentraciones son utilizadas, aunque no se trata de pruebas económicas. Por cierto que también se dispone de métodos para la determinación de la CIM en forma rápida en placas de microtitulación que usan un número pequeño de concentraciones de cada antibiótico.
Actualmente se cuenta con pruebas basadas en técnicas moleculares, a
través de las cuales se detecta con simpleza segmentos de DNA que codifican resistencia (Bergeron & Oulette, 1998). Si bien estas pruebas no son utilizadas rutinariamente aún, representan herramientas esenciales que van a ir generalizándose, perfeccionándose, y aportando información muy importante en la prevención de la resistencia.
Como comentáramos en secciones anteriores, estos métodos solamente
son orientadores y mucho se ha trabajado tratando de acercarlos a la realidad del crecimiento bacteriano en los verdaderos hospedadores. Es interesante mencionar que el comportamiento de un antimicrobiano cambia diametralmente en plasma o leche. Para desarrollar una actividad equipolente frente a Staphylococcus aureus, la ampicilina debe estar 200 veces más concentrada en leche que en plasma. Esto sugiere claramente que un método de detección de susceptibilidad bacteriana realizado en suero, será muy poco representativo de lo que ocurra cuando se trate una infección en la glándula mamaria y que el desarrollo de metodologías basadas en cultivos en leche, para definir tratamientos en leche, sería lo más adecuado (Watts & Yancey, 1994).
8. Criterios de susceptibilidad y resistencia
Dadas las diferencias, que como hemos explicado, existen entre las pruebas "in vitro"y lo que realmente ocurre con los microbios en el organismo, los resultados deben ser cuidadosamente analizados. Sin embargo, la experiencia indica que, cuando esto último ocurre, la terapia puede instituirse con base sólida.
Es importante tener en cuenta que la concentración inhibitoria mínima
(CIM) por sí misma, no aporta datos de gran valor para el clínico. Esos datos se vuelven valiosos cuando se los interpreta en función de las concentraciones que la droga puede alcanzar en el organismo. De esta manera, una CIM determinada indicará que el microorganismo que se pretende erradicar es muy susceptible, cuando las concentraciones que la droga puede alcanzar "in vivo", están varias veces por encima de esa CIM y, esto, según de qué droga se trate se mantiene por más o menos tiempo durante el intervalo interdosis.
Con las metodologías mencionadas, se pueden fijar límites de
resistencia, este límite estaría dado por aquellas CIM que no pueden ser
Uso de antimicrobianos en animales de consumo
alcanzadas con los regímenes posológicos convencionales. Hay también una zona intermedia, en que no se puede catalogar al microorganismo en susceptible o resistente. Esto, sin embargo, no es excluyente: Medicamentos con elevado índice terapéutico, pueden ser administrados en dosis más elevadas que las habituales y, de esta manera, ubicar sus concentraciones claramente por encima de la CIM del microorganismo. También puede ocurrir que, cuando la infección está localizada en determinados tejidos, órganos o sistemas, en que la droga se concentra en forma muy diferente que en plasma, no podamos extrapolar con facilidad datos de concentraciones plasmáticas e interrelacionarlos con la CIM. Considerándose las concentraciones plasmáticas como guía, la llegada de la droga puede ser subestimada, como ocurriría con los beta lactámicos en orina (estos se concentran mucho a este nivel) o sobreestimada, como ocurriría con casi cualquier antibiótico a nivel de líquido cefalorraquídeo.
En definitiva, se debe interpretar el estudio de laboratorio a la luz de las
características farmacocinéticas de la droga en cuestión. Para poder hacer una correcta intepretación, se debería tener un conocimiento acabado de: la distribución poblacional de la bacteria problema (susceptibilidad de muchos aislamiento de campo), la farmacocinética del agente (no sólo la plasmática, sino la tisular) y los resultados de los estudios de eficacia. Una nueva disciplina la modelización farmacocinética-farmacodinámica puede representar la unión final entre datos que en oportunidades son presentados como fragmentarios y aportar al esclarecimiento de nuevos conceptos que hacen a planes de administración racionales y eficaces. Esto será más claramente expuesto cuando hablemos de relación farmacocinética-farmacodinámica.
9. La evolución de la metodología analítica
Los métodos de detección de antimicrobianos han ido evolucionando con el tiempo, hasta llegar actualmente, a la determinación de niveles muy bajos. Esto es de fundamental importancia en el caso de los residuos de antimicrobianos. La industria láctea, por un problema de seguridad tecnológica ha ido perfeccionando los niveles de detección a través de pruebas sencillas, rápidas, sensibles y específicas que permiten definir el destino de la leche a la llegada a la fábrica. El consumidor se ha visto favorecido por esta política, dado que los niveles de inhibidores que se aceptan para cumplir con la seguridad toxicológica, están en el mismo orden de magnitud, en términos muy generales, a los de la seguridad tecnológica.
La metodología ha ido variando en función del tiempo. Pero siempre se
ha mantenido vigente la metodología biológica, que combina rapidez, practicidad, sensibilidad y economía.
Uso de antimicrobianos en animales de consumo
Esto es algo que está estrechamente vinculado con la percepción que los
científicos han tenido sobre la presencia de residuos de medicamentos en tejidos comestibles y, por supuesto, por la percepción del público. En un inicio, cuando las metodologías de detección eran poco sensibles, se manejaba la hipótesis de residuo cero. Esto significaba que si se detectaba la sustancia en cuestión en el alimento analizado, éste no era apto para el consumo. Posteriormente, con la enorme mejora en las metodologías de detección y la sustancial baja de los límites de detección y cuantificación de productos químicos, se debió recurrir a los límites de residuos, que no son otra cosa que concentraciones de droga en determinado tejido por debajo de las cuales el tejido es considerado seguro para el consumidor, como explicaremos más adelante.
10. Concentraciones de residuos y su interpretación intuitiva
Es un poco difícil imaginarse lo que significa una parte por millón (PPM),
por billón (PPB) o por trillón (PPT). También lo es interpretar la magnitud de
dilución que representan esas medidas, y aunque se lo represente en otra
forma, digamos miligramos por mililitro (mg/mL) o por litro (L), tampoco
esto es fácil de intuir. Mucho menos cuando hablamos de nanogramos o
picogramos por mililitro (ng o pg/mL). Debemos tener en cuenta que con las
metodologías analíticas actuales, la determinación de concentraciones en el
orden de los ng o pg/mL es normal con las rutinas de ensayo en los
laboratorios analíticos. Concentraciones más bajas aún pueden ser
determinadas por medio de metodologías y equipamientos más sofisticados.
Por lo tanto, y a los fines ilustrativos se presenta en la Tabla 3 una
equivalencia entre las partes por millón, billón o trillón, las unidades por
mililitro o litro y la dilución en términos manejados intuitivamente por el
público. Esta tabla nos da una clara idea sobre la enorme sensibilidad que
han alcanzado las metodologías analíticas en los últimos años.
TABLA 3. Equivalencias entre diversas unidades de medida y términos
de manejo corriente
Definición de
Notación
laboratorio
científica
peso/vol
Peso Volumen
1 sobrecito de azúcar
1 sobrecito de azúcar
1 jarra de un litro
1 sobrecito de azúcar
1 tanque de mil litros
1 sobrecito de azúcar
1 camión tanque
1 sobrecito de azúcar
1 sobrecito de azúcar
1 sobrecito de azúcar
Mg: miligramo; µg: microgramo; ng: nanogramo; ft: femtogramo.
Uso de antimicrobianos en animales de consumo
Las ingestas diarias aceptables y los límites máximos de
residuos
Los estudios toxicológicos de residuos de medicamentos se basan en la determinación de ingestas diarias aceptables. Estas se obtienen en animales de laboratorio, luego de administrarles el medicamento en el alimento durante períodos prolongados de tiempo. De esta manera se determina el nivel de dosis sin efecto (NOEL) y la ingesta diaria admisible (ADI). La ingesta diaria admisible es la máxima cantidad del medicamento que la especie experimental puede recibir sin ningún tipo de manifestación toxicológica. Pero esta es la parte que se lleva a cabo en animales de laboratorio. Luego debemos, de alguna manera extrapolar al hombre, cosa que no es fácil. En general, lo que se hace es aplicar a la ingesta diaria aceptable del animal de laboratorio un factor de seguridad que se ubica normalmente en un valor de 100, aunque a veces puede ser mas bajo y, en oportunidades, ser elevado a 1000 (cuando los riesgos lo justifican). De esta manera se obtiene la ADI para el consumidor humano. El MRL es, simplemente, el máximo nivel de residuos que se puede aceptar en un determinado alimento para que un humano que lo consume en forma normal y abundante no supere el ADI para la droga en cuestión. Otro parámetro, de especial importancia, especialmente tratándose del tema que nos ocupa, es el nivel de dosis sin efecto microbiológico (NMEL), que es el nivel de dosis que no produce efecto contra las especies bacterianas más sensibles, poniendo énfasis en las especies saprófitas del tracto gastrointestinal humano.
12. ¿Cuáles son los riesgos de la presencia de antimicrobianos
en alimentos?
Clásicamente la presencia de antimicrobianos en alimentos se ha asociado a distintos problemas, a saber:
a. Alérgicos b. Tóxicos c. Asociados a las resistencias bacterianas
Los problemas alérgicos son conocidos y afectan a la población sensibilizada. En general las bajas concentraciones de antibióticos alergénicos (i.e. beta lactámicos) no alcanzan para sensibilizar pacientes (aunque puede haber excepciones), pero sí para desencadenar reacciones que, en general, no son graves, aunque, eventualmente, pueden llegar a serlo (anafilaxia).
Algunos otros grupos de antibióticos son capaces de desencadenar
reacciones alérgicas como las sulfamidas. De todas maneras siempre hay un componente fuertemente individual en estas reacciones que está representado por el terreno inmunológico del paciente.
Uso de antimicrobianos en animales de consumo
Los problemas toxicológicos, por su parte, son bastante difíciles de
probar, dadas las bajas concentraciones residuales de estas drogas. Los aminoglucósidos, por ejemplo, son productos tóxicos. Su ototoxicidad y nefrotoxicidad han sido clásicamente descriptas. Sin embargo, insistimos, a concentraciones residuales, es posible que no existan riesgos toxicológicos para este grupo de drogas. Por cierto que, si se envían a consumo riñones de animales tratados, las concentraciones de droga serán más elevadas, dada la facilidad con que los aminoglucósidos se acumulan en este órgano. De todas maneras y, aún en este caso, será difícil que el consumo de un riñón en estas condiciones pueda generar problemas toxicológicos, dada la baja posibilidad de que un paciente continúe consumiendo riñones con residuos elevados de aminoglucósidos en forma continuada por un tiempo prolongado.
El que sí es capaz de dar lugar a problemas tóxicos es el cloranfenicol, y
en este caso a dosis probablemente muy bajas. El cloranfenicol es capaz de producir dos tipos de manifestaciones toxicológicas: a. Una mielo depresión dosis dependiente que se presenta en el curso de un tratamiento con la droga y b. Una anemia aplástica, que es dosis independiente, que desarrolla en individuos susceptibles, y que es irreversible una vez instalada. Los derivados fenicoles tianfenicol y florfenicol, si bien pueden generar algún tipo de mielo depresión dosis dependiente, que cede al suprimir el tratamiento o bajar la dosis, no son capaces de producir la anemia aplástica que puede producir el cloranfenicol. Esta es la razón de que el cloranfenicol haya sido prohibido en algunos países, pero no haya ocurrido lo mismo con los otros fenicoles.
Como mencionáramos al inicio de esta sección, la resistencia bacteriana
ha sido asociada largamente a la presencia de residuos de antibióticos en alimentos humanos. Sin embargo, y pensando lógicamente, las concentraciones residuales de antibióticos presentes en alimentos provenientes de animales tratados, difícilmente sean capaces de seleccionar bacterias resistentes, dado que a tan bajas concentraciones los antibióticos no pueden actuar sobre microorganismos resistentes ni sensibles. Especialmente cuando esas concentraciones se encuentran por debajo del NMEL.
La resistencia bacteriana es un problema gravísimo que representa una
preocupación mundial, que se produce por múltiples causas, que probablemente sea inevitable y con la que tenemos que lidiar en forma multidisciplinaria a efectos de limitar su emergencia y paliar sus efectos al máximo.
El riesgo más grande para la salud de los consumidores que implica la
utilización de antibióticos en animales no está dado por los residuos, sino por el desarrollo de resistencias en bacterias de los mismos animales. Estas resistencias pueden, por supuesto, dar lugar a fallos terapéuticos en tratamientos veterinarios, y al riesgo de transferencia de bacterias resistentes de los animales al hombre, o de genes portadores de información que codifica resistencia de bacterias de animales a bacterias humanas.
Uso de antimicrobianos en animales de consumo
La resistencia a los antimicrobianos, sus mecanismos y
La base del desarrollo de la resistencia bacteriana está en la selección de cepas resistentes que producen ciertas concentraciones de antibiótico. El antibiótico no induce resistencia, solamente selecciona. Es una interferencia en el proceso de selección natural. Donde antes se seleccionaban las bacterias más aptas para la supervivencia en el sitio del organismo de que se trate, en presencia del antibacteriano, sobrevivirán solamente aquellas variantes capaces de resistir a las concentraciones de antibiótico presentes en ese lugar. El antibiótico se convierte en el primer factor de selección.
El uso de los antibacterianos ha cambiado no solamente los clásicos
cuadros sintomatológicos que habían sido excelentemente descriptos en siglos anteriores de buena clínica, sino las bacterias mismas, sus susceptibilidades y, consecuentemente, las posibilidades de tratamiento y curación.
Luego de la introducción en la clínica de cada nueva droga, es un
proceso probablemente inevitable, que en un plazo variable de tiempo, aparezcan variantes resistentes de la bacteria contra la que se pretende luchar con la nueva arma. Esto se ha ido cumpliendo inexorablemente con la mayoría de los agentes antimicrobianos. Esto no implica que, con el uso criterioso y racional de los antimicrobianos, no se pueda limitar al máximo la emergencia de resistencias.
La resistencia de una bacteria no es la misma para todos los miembros de
la población. Para individuos indiferenciables morfológica o bioquímicamente, puede haber variedades con susceptibilidades totalmente diferentes, muy susceptibles, es decir que son eliminadas por bajas concentraciones del antibiótico, o muy resistentes, que son muy difíciles de erradicar, aún administrando el antibacteriano en concentraciones elevadas. Pero cuando se hace un aislamiento de una determinada infección, se supone que se trata de una cepa bastante pura, que es la que produce el proceso morboso. Al estudiar su susceptibilidad a un determinado agente antiinfeccioso a través de su CIM, podremos, al correlacionar este parámetro con sus variables farmacocinéticas, estimar su eficacia "in vivo". Cuando las concentraciones que el antimicrobiano puede alcanzar en el organismo no superan la CIM sustancialmente y durante tiempos prolongados, aunque vinculados al tipo de agente de que se trate, la bacteria tiene todas las posibilidades para sobrevivir y la podemos definir como resistente. En cambio, cuando ocurre lo opuesto, la bacteria es definida como susceptible.
Esto es lo que ocurre con las resistencias adquiridas, aquellas en que el
antibacteriano actúa, como se ha explicado, seleccionando entre microorganismo resistentes y susceptibles. Pero hay otro tipo de resistencias, las denominadas resistencias intrínsecas, aquellas que son parte constitutiva
Uso de antimicrobianos en animales de consumo
de la bacteria. Por ejemplo las diferencias, de membrana entre bacterias Gram positivas y Gram negativas, hacen que los antibióticos beta lactámicos no encuentren el receptor adecuado para fijarse y ejercer su efecto en las últimas.
Sin embargo, es la resistencia adquirida la que nos interesa y sobre ella
nos vamos a extender más. El origen de la resistencia adquirida es genético. El puntapié inicial de la resistencia es una mutación que permite que algún mecanismo bacteriano cambie lo suficiente para que los sistemas que la droga normalmente modifica, no existan más o sean suficientemente distintos como para que el antimicrobiano no pueda actuar. Sobre esta mutación actúa luego la selección ejercida por el antibiótico. Mayor importancia aún tiene el mecanismo de la transferencia de material genético.
En términos generales, las resistencias no parecieran tan difundidas en
bacterias Gram positivas. Las Gram positivas no son capaces de incorporar plásmidos. Aunque este no es el caso de los estafilococos, en los que las resistencias a los antimicrobianos se han transformado en un serio problema. En el caso de los Gram negativos, esto sí que es grave. La resistencia está diseminada en organismos Gram negativos y se transfiere con facilidad.
La transmisibilidad de los factores de resistencia puede dar lugar a un
problema aún mayor: la multi-resistencia. Estos microorganismos no solamente son resistentes a una serie de drogas, sino que esa multi-resistencia sigue siendo transferible, por lo que se transforman en reservorios de resistencia. Otro factor de riesgo es la capacidad de sobrevivir en ausencia del antibiótico protector.
De todas maneras, ante el uso de antibióticos, las bacterias desarrollarán,
indefectiblemente, resistencias. Es muy difícil interpretar de donde viene la resistencia, algunos genes pudieron estar esperando evolucionar. Otros genes pudieran haber existido en bacterias no patógenas y haber sido transferidos a especies de interés médico (O'Brien, 1997). Sabemos que existían plásmidos codificados para resistencia en la era preantibiótica. Seguramente la resistencia es tan antigua como la síntesis de antibióticos por bacterias. Por ejemplo, en el caso de actinomicetos, es frecuente hallar resistencias a los agentes que esos mismos microorganismos producen (Burns, 1995). Heinemann y col (2000) argumentan que no hay coevolución entre resistencia y susceptibilidad, ellos dicen que la disminución en el uso de antimicrobianos tanto en medicina como en agricultura no reemplazará un cambio fundamental en el diseño de medicamentos para frenar la evolución de las resistencias y favorecer la evolución de cepas susceptibles.
Uso de antimicrobianos en animales de consumo
13.1 Las resistencias cromosómicas
Este tipo de resistencias dan lugar, en general, a cambios estructurales. Son cambios, en general, graduales. Se producen por mutaciones que son errores, raras, que se producen en el proceso de replicación del ADN. Estas mutaciones pueden generar muy profundos (y algunas veces rápidos) cambios en el nivel de resistencia, como es el caso de la estreptomicina cuya CIM puede aumentar mil veces a través de una sola mutación. Clásicamente, antes de conocerse los mecanismos que la producían, el desarrollo de resistencias rápidas fue definido como resistencia tipo estreptomicina. En el caso de resistencias más lentas, se las conocía como resistencias tipo penicilina. Esto indudablemente habla a las claras de que había una comprensión intuitiva del fenómeno, pero seguramente no de su gravedad (por cierto que se ignoraba la existencia de las resistencias transmisibles).
La mayoría de las veces, las mutaciones son escalonadas, lentas, como
en el caso de las quinolonas. Esto requiere una mutación a nivel del gene que codifica la producción de una enzima (girasa de ADN) que ayuda en el proceso de transcripción de ADN. Sin embargo, a veces, el desarrollo de resistencia a quinolonas es más rápido, como en el caso de las enterobacteriáceas en que una sola mutación da lugar a un nivel bajo de resistencia, requiriendo una segunda mutación para adquirir un nivel elevado. Por su parte, en Campylobacter, una sola mutación es capaz de generar un elevado grado de resistencia a quinolonas. En este caso en particular, el desarrollo de resistencia no requiere de ADN externo, solamente la droga y la bacteria, no hay transferencia horizontal de resistencia, la transferencia es vertical solamente a través del clon resistente (Acar et al, 1993).
La estreptomicina, utilizada como tuberculostático humano durante
muchos años, fue, en base a la experiencia, siendo asociada con otros tuberculostáticos, para aumentar la eficacia y, fundamentalmente para prevenir el desarrollo de resistencias. Esto, que actualmente tiene vigencia, también debería ser utilizado en el caso de drogas como rifampicina y ácido nalidíxico, para las cuales las bacterias también desarrollan rápidamente resistencias y que, siendo asociadas, disminuyen, obviamente, la posibilidad de mutación del microorganismo frente a dos agentes de mecanismos de acción distintos. La vancomicina, en el otro extremo es una droga para cuya resistencia difícilmente las bacterias muten.
13.2 Las resistencias transferibles
En este caso, la bacteria obtiene la información genética que codifica resistencia de otra bacteria, que es resistente. La magnitud y la velocidad de este fenómeno son su característica excluyente. La obvia pregunta es, pero ¿de dónde proviene el material genético original? Mucho se ha discutido
Uso de antimicrobianos en animales de consumo
sobre esto. Se piensa que ese material puede provenir de microorganismos resistentes naturalmente o de bacterias productoras de antibióticos, a través de mecanismos de picking-up y recombinación de genes.
El conocimiento de este fenómeno, ignorado en su magnitud hasta hace
pocos años, ha revolucionado el ambiente médico. La posibilidad de que las bacterias intercambien material genético y con el mismo, resistencias, puede incrementar enormemente la diseminación de los microorganismos resistentes. La resistencia está codificada en ADN extracromosómico que se autoduplica dentro de la bacteria y es transferido a otras por mecanismos varios, que veremos más adelante.
La primera descripción de resistencia transferible fue hecha en Japón en
los años 50 (Davies, 1997). Sin embargo se ignoraba la magnitud e importancia que ese fenómeno iba a tener en el tratamiento de las enfermedades infecciosas humanas y animales. Los genes que codifican resistencia a antibióticos fluyen desde y hacia bacterias Gram positivas y Gram negativas y bacterias que habitan nichos extremadamente diferentes (Levy, 1997). Las transferencias "horizontales", entre géneros bacterianos diferentes, son, lamentablemente, frecuentes.
Es muy importante, como lo mencionan Prescott y cols (2002),
considerar que, probablemente haya sido el interés científico, que haya enfocado sus prioridades sobre las bacterias patógenas, desestimando lo que podría ocurrir con las saprófitas. Mientras tanto, esta porción "inofensiva" de la población bacteriana de los organismos animales y humanos siguió actuando como reservorio de resistencias. Esta hipótesis conocida como "hipótesis del reservorio" asume que cierta concentración umbral de antibiótico es necesaria para inducir (seleccionar) y luego mantener resistencias, asumiendo también que los genes mutados y responsables de la resistencia, no son fenotípicamente neutrales, sino que implicarían una cierta incompetitividad por parte de la bacteria en ausencia de la droga. La concentración umbral sería aquella capaz de seleccionar bacterias, aún saprófitas. La droga debería ser utilizada en una escala tal, que las raras bacterias resistentes, prosperarían hasta hacerse cargo de todo aquello dejado libre por las bacterias susceptibles (Sundin and Bender, 1996; Hayward and Griffin, 1994; van der Waaji et al, 1971; Stobbering et al, 1999). Según esta hipótesis, la supresión del uso del antibacteriano al que los microorganismos han desarrollado resistencia, debería generar un fenómeno inverso, a través del cual, la población resistente, lentamente dejaría lugar a cepas susceptibles. Pese a ser una explicación muy razonable del fenómeno de diseminación de la resistencia, esta hipótesis es fuertemente cuestionada por algunos autores, Heinemann et al (2000).
El tracto gastrointestinal animal y humano ha sido considerado como el
lugar de elección de las transferencias de resistencias. Otros nichos, sin embargo, comienzan a ser considerados como de gran importancia. Así, el
Uso de antimicrobianos en animales de consumo
intestino de animales salvajes (especialmente roedores), animales de compañía, y, esencialmente peces, en especial considerando explotaciones comerciales para producción de éstos, representan lugares en que el fenómeno se produciría en gran escala. El medio ambiente representa, en ciertas circunstancias especiales, un lugar de intensa actividad microbiana, donde los intercambios podrían tener lugar en forma extensa. Así, ciertos lugares como la tierra, especialmente en zonas en que se produzcan descargas de materia fecal, producto, por ejemplo de limpieza de corrales, podría funcionar de esta manera. Por cierto que los cursos de agua, especialmente si se los vincula al vertido de desechos cloacales (especialmente si éstos no han sido tratados previamente a su descarga), serían lugares ideales de intercambio.
Como fue presentado en el Documento de Base de la Consulta de
Expertos en Uso No-humano de Antimicrobianos y Resistencia Antimicrobiana organizada en conjunto por Organización Mundial de la Salud, Organización de las Naciones Unidas para la Agricultura y la Alimentación y la Organización Mundial de la Salud Animal (FAO/OIE/WHO, 2003), hay un conjunto de factores que deben ser considerados en la diseminación exitosa de clones resistentes en humanos y animales, estos factores incluirían:
x Capacidad de la bacteria de sobrevivir y competir con otros clones
en el mismo nicho u otros.
x El potencial de adaptarse a nuevos ambientes. x La resistencia a las condiciones del medio, incluyendo factores
físicos y químicos.
x La capacidad de colonizar hospedadores animales y humanos y
reproducirse luego de colonizar.
x La habilidad para superar la respuesta inmune del hospedador. x La estructura de la industria animal: Infecciones arriba en la
pirámide, en animales de élite genética pueden generar diseminación hacia abajo en la descendencia.
x El manejo de las explotaciones, esto incluye disposición de
materia fecal y movimientos de animales.
x La resistencia (esencial) a otros antimicrobianos usados para otros
13.3 Los mecanismos de transferencia de resistencias pueden
clasificarse en:
x Plásmidos x Transposones x Integrones y casetes genéticos
Uso de antimicrobianos en animales de consumo
Los plásmidos son porciones circulares de ADN extracromosómico que
puede estar codificado para resistencia a un determinado antibiótico. Cuando
codifican resistencias se los denomina plásmidos R. Los plásmidos son
autorreplicantes, independientemente del ADN cromosómico. En general
codifican características que mejoran los rasgos de supervivencia de las
bacterias, sin ser imprescindibles para la misma. Pueden ser transferidos ente
bacterias del mismo, o diferentes géneros. La adquisición de resistencia por
parte de la bacteria receptora, por lo tanto, es en un paso. Un plásmido puede
ser incorporado por un virus y transferido a otra bacteria. En general se cita
como ejemplos a los bacteriófagos. También puede pasar de una célula a otra
por conjugación.
Transposones: Son los ya clásicamente conocidos como genes
saltarines. Son cadenas cortas de ADN que saltan de cromosoma a plásmido, en uno u otro sentido, entre plásmidos o entre plásmidos y bacteriófagos. La característica más saliente de este tipo de material es la de integrarse con facilidad a cadenas de ADN diferente del original. A diferencia de los plásmidos, los genes saltarines no son autorreplicantes, deben mantenerse dentro de una estructura autorreplicante para replicarse. Un rasgo central y peligroso de los transposones es la posibilidad de que varios de ellos, codificando resistencias a múltiples drogas, estén incluidos dentro de un mismo plásmido, lo que permite, por transferencia de este último, la adquisición de multirresistencia por parte de la bacteria receptora.
Integrones y casetes genéticos: Diferentes de los transposones pero de
mecanismos algo parecidos. Se recombinan en un sitio específico y codifican resistencia a un solo antibiótico. Junto con los transposones, son los sistemas que más actúan en la adquisición de resistencias por parte de los plásmidos. Constan de tres regiones, dos invariables y una central variable, que es la que porta el casete. El denominado casete es un elemento que incluye un gene y un sitio recombinante. Se han identificado más de cuarenta casetes y la mayoría porta genes de resistencia (Hall, 1997).
13.4 ¿Cuáles son los mecanismos de resistencia?
Las bacterias pueden volverse resistentes a los antimicrobianos, pero, ¿por qué mecanismos? Así como el primer mecanismo de acción de un agente infeccioso conocido fue el de las sulfamidas, el primer mecanismo de resistencia conocido también fue el de los microorganismos a estas drogas. Si bien son varios los mecanismos de resistencia a las sulfas que actualmente se conocen, podemos decir que la hiperproducción de PABA fue el primero en determinarse, siendo el más conocido. Además de la hiperproducción metabólica, otros mecanismos incluyen:
Uso de antimicrobianos en animales de consumo
13.4.1 Inactivación enzimática de los antibióticos, como es el caso de
las enzimas beta lactamasas. En este caso la enzima, elaborada por la bacteria, inactiva a la molécula de la droga volviéndola incapaz de actuar. Hay que tener presente que este mecanismo es el único capaz de inactivar a la molécula de antimicrobiano.
13.4.2 Impermeabilidad de la membrana o pared celular. Por ejemplo
modificaciones en las porinas, lo que repercutirá en resistencias de bajo nivel a diversos antimicrobianos.
Expulsión por mecanismos activos del antibiótico. Las
resistencias a las tetraciclinas pueden se debidas a este tipo de mecanismos.
13.4.4 Modificación del sitio blanco del antibiótico en la bacteria. El
algunos casos hay una reducción de la afinidad del receptor por la molécula de antimicrobiano. Una mutación de la girasa de ADN, por ejemplo, puede dar lugar a una menor afinidad de las quinolonas por la citada enzima. Otro ejemplo es el cambio de las enzimas involucradas en la síntesis de ácido paraaminobenzoico, lo que da lugar a resistencias a sulfas y trimetoprima, mecanismo que se suma al mencionado en primer lugar.
13.5 Bacterias resistentes en medicina veterinaria
Es evidente la relación entre antibióticos y resistencia bacteriana. No obstante, es claro también que hay bacterias que desarrollan resistencias con mayor facilidad que otras.
También es cierto que mucho se habla y poco se comprueba sobre las
resistencias humanas y animales y las eventuales transferencias entre especies.
En medicina veterinaria existen casos bien documentados de bacterias
del género Salmonella y otras entéricas Gram negativas como Escherichia coli que pueden afectar también al hombre. Un importante elemento de riesgo es el enorme potencial de intercambio genético que existe en el intestino. Esta es una de las causas que explican que sean estos dos géneros Gram negativos los que representen los mayores riesgos de transferencia zoonótica de resistencias.
La resistencia de E. Coli a los antibióticos es un fenómeno descripto
hace tiempo y la vinculación entre la aplicación de antibióticos y su emergencia estaría demostrada según Linton (1977).
La manutención de animales en condiciones de crianza intensiva, bajo
presión quimioterápica, es la forma ideal de generar resistencias. Este hecho fue demostrado por primera vez en 1957 por Smith, en cerdos tratados con tetraciclinas en la dieta. Debemos tener presente que fue en esa época cuando la actividad promotora del crecimiento de los antibióticos fue descubierta y utilizada en forma extensiva. Con el paso del tiempo, esas cepas resistentes de E. Coli compitieron con éxito con las susceptibles en el contenido
Uso de antimicrobianos en animales de consumo
intestinal. Uno de los problemas actuales es que incluso la suspensión de los tratamientos con tetraciclinas puede no resolver el problema dado que por acción de los transposones, la codificación de la resistencia radica, en muchos casos, en los cromosomas.
En general, y cuando un tratamiento es corto, hay una eliminación de
cepas saprófitas sensibles de E. Coli y una enorme predominancia de cepas resistentes. Sin embargo, no se trata de un fenómeno permanente. Las bacterias persistirán, si el antibiótico continúa siendo administrado. Si no, pierden su defensa, y las bacterias susceptibles vuelven a predominar. Cuando, por el contrario, el uso del antibiótico es por tiempos prolongados, aquí los organismos resistentes pueden persistir, incluso sin el antibiótico que los proteja.
El caso de la Salmonella thyphimurium es interesante, dado que la
multirresistencia en aislamientos animales ha sido descripta extensivamente. Hay ciertos bacteriófagos que toman plásmidos codificadores de resistencia de E. Coli y los pueden transferir a S. Typhimurium. Los casos de resistencia de S. typhimurium son comunes en aislamientos de terneros.
Algunas variantes resistentes de Salmonella tienen la característica de
emerger y, un tiempo variable después declinar en prevalencia. Históricamente, aislamientos de serotipos multirresistentes de S. typhimurium, fagotipo 29, fueron hechos en 1965 (Anderson 1968). En esa época el microorganismo comenzó a presentarse en la población humana. En la década del 70, el fagotipo 29 se había transformado en raro, pero emergieron cepas multirresistentes, causando estragos en la población bovina en G. Bretaña, los fagotipos 204, 193 y 204c. Este brote cruzó al continente europeo y también se presentaron casos humanos. También en USA se describieron casos de antibioticorresistencia en Salmonella, relacionándosela con infecciones y resistencia en animales (Sun 1984). El 204c predominó hasta los años 90, en que declinó. Recientemente una cepa multirresistente de S. typhimurium fue aislada del ganado, para el que es muy patógena, al mismo tiempo que para otros organismos, incluyendo al hombre. Esta es una cepa, al parecer originada en Inglaterra y difundida luego a todos los continentes, el fagotipo DT 104, que causa enfermedad severa en aves, bovinos y cerdos (Wall, 1997). A diferencia de los anteriores fagotipos en este caso la multirresistencia parece estar integrada al cromosoma. Este microorganismo es el más utilizado en la argumentación sobre uso de antibióticos en animales y desarrollo de resistencias que puedan causar enfermedad seria en el hombre.
Las fluoroquinolonas de uso veterinario, aparecen en la década del 90 en
medio de discrepancias porque era el único grupo nuevo de antibacterianos disponible. Se trata de un grupo de drogas que se puede utilizar en forma terapéutica y eventualmente preventiva en el hombre y de la misma manera en los animales, ya que, en estos últimos no se las usa como promotores del
Uso de antimicrobianos en animales de consumo
crecimiento. Luego de varios años de uso en Europa, aparecieron cepas de Campylobacter jejuni resistentes a fluoroquinolonas (Smith y et.al, 1999).
La resistencia de S. thyphimurium a fluoroquinolonas, merece un
tratamiento especial. Woolridge (1999), en un reporte para EMEA, hace un análisis cualitativo de riesgo en que estudia Salmonella thyphimurium y quinolonas. En su análisis concluye que hay una baja probabilidad de S. thyphimurium resistentes debida a uso de quinolonas, que la probabilidad humana de exposición a esas salmonellas por alimentación también es baja, que es muy poco probable que esas salmonellas colonicen al hospedador humano y menor aún de que produzcan algún efecto adverso. Todo esto es concluido con un elevado grado de incerteza, pero aún así, son datos extremadamente interesantes. Parece lógico que falta recolección de datos confiables con métodos reproducibles a nivel mundial, para sacar algún tipo de conclusiones en estos temas.
Uno de los problemas más conocidos dentro de esta historia es el
vinculado a la aparición de cepas de enterococos resistentes a los glucopéptidos. Estas cepas han emergido de hospitales, en los que el uso intensivo oral e intravenoso de vancomicina es cotidiano. Además del uso intensivo, se ha mencionado a la duración de la internación, enfermedades concomitantes, intensidad de la exposición al antibiótico y uso adicional de antibióticos de espectro más amplio, como es el caso de las cefalosporinas (Segal-Maurer, 1996).
Independientemente del fenómeno mencionado, se describió otro,
asociado a la utilización de la avoparcina. Se trata de una molécula glucopeptídica usada como promotor del crecimiento en granjas de pollos y cerdos en Europa. Tiene una vinculación estructural con la vancomicina. La emergencia del enterococo (un comensal de la flora normal del intestino del hombre) como patógeno hospitalario en pacientes inmunodeprimidos, siendo la vancomicina la única droga disponible para su tratamiento, ha hecho que, la aparición de la resistencia a vancomicina de los enterococos, encendiera la luz roja y motorizara la prohibición del uso de la avoparcina en animales. A la luz del conocimiento actual, las cepas de enterococos resistentes de animales pueden colonizar al hombre. Y si la vancomicina no se puede usar para el tratamiento, la enfermedad la terapia se vuelve extremadamente complicada. Se ha medido una tendencia a la declinación de la presencia de enterococos vancomicina resistentes en el intestino humano en Europa, luego de la prohibición de la avoparcina (Klare et al, 1999), esta tendencia indicaría dos cosas: Por un lado que el origen de cepas peligrosas en animales, ciertamente sería de incidencia en salud pública (Klare et al, 1999); por el otro, que aún en este caso tan serio, se da una aparente disminución de la resistencia en ausencia del agente seleccionador. Pero por otra parte, las epidemias causadas por enterococos vancomicina resistentes han sido pocas en Europa, especialmente si las comparamos con las epidemias en EEUU,
Uso de antimicrobianos en animales de consumo
con mucha más razón si consideramos que en este país, la avoparcina nunca fue aprobada para su uso en animales (McDonald et al, 1997). Por otra parte las cepas norteamericanas de enterococos multirresistentes son, en general, resistentes a más antimicrobianos. Esto, lejos de aclarar las cosas, las complica en extremo, dado que no se logra establecer una relación causal entre el uso del promotor del crecimiento y la generación de resistencia y, cuando esta se establece, como en el caso europeo, surge la evidencia del caso norteamericano para ponerla en duda.
Últimamente, la quinupristina-dalfopristina, una estreptogramina, fue
aprobada para el tratamiento de infecciones por enterococos resistentes en el hombre. Se trata de una molécula de la misma familia que la virginiamicina, largamente utilizada en animales, cuyo uso animal fue suspendido. Se demostró que la virginiamicina, usada como promotora del crecimiento, había seleccionado enterococos resistentes en Europa (Bogaard et al, 1997).
Ziv (1995) nos aporta datos interesantes en lo que hace a patógenos
causantes de mastitis: A pesar del uso extensivo que se ha hecho de los antimicrobianos para el tratamiento de vacas productoras de leche en le momento del secado durante los últimos 20 años, no existen evidencias de desarrollo de resistencias vinculadas a los tratamientos en bacterias Gram positivas o Gram negativas. En este caso, debemos dejar claramente establecido que los tratamientos bovinos terapéuticos durante la lactación por casos de mastitis y profilácticos, durante el llamado "secado terapéutico" son siempre durante períodos de tiempo cortos. Los tratamientos en lactación no se extienden durante más de 3, o como máximo 4 días, mientras que los tratamientos durante el período de secado mantienen concentraciones en la glándula durante períodos más largos, pero que, obviamente, no pueden superar el período en que la vaca no es ordeñada. Generalmente las concentraciones del antimicrobiano, se mantienen dentro de niveles inhibitorios un tiempo sensiblemente más corto que el período durante el cual la vaca no produce leche, con un rango de unos 15-60 días. Este es un dato más a favor de la hipótesis de que se necesitan tratamientos muy prolongados para generar resistencias.
13.6 Las bacterias resistentes en la población humana
Como hemos mencionado anteriormente las resistencias bacterianas han sido identificadas desde hace mucho tiempo, aunque quizás no tan bien la magnitud de su impacto en salud publica y salud animal. Si bien no hay demasiados datos en lo que hace a resistencias en bacterias que afectan seres humanos, la mayor información proviene, en forma bastante lógica, del campo hospitalario.
Uso de antimicrobianos en animales de consumo
Un listado de las bacterias resistentes de mayor trascendencia en
infecciones hospitalarias, debería incluir a:
x Estafilococos meticilino-resistentes x Enterobacter cloacae x Enterococos x Pseudomonas aeruginosa
Por su parte, en la población urbana o rural, las infecciones por microorganismos resistentes serían causadas por:
x Streptococcus pneumoniae x Streptococcus pyogenes x Escherichia coli x Mycobacterium tuberculosis x Neisseria gonorrheae x Salmonella x Campylobacter
13.7 La llegada de las bacterias animales a la población humana
Escherichia coli multirresistentes, Salmonella typhimurium multirresistentes, enterococos vancomicina resistentes, Campylobacter quinolonas resistentes, son microorganismos que habrían emergido, por lo menos en parte de explotaciones agropecuarias. Este hecho se debe sumar al conocimiento de la enorme capacidad de intercambio genético existente en el intestino, y de la magnitud del reservorio de resistencia representado por los microorganismos saprófitos que lo pueblan, que, como bien se sabe, bajo presión antibiótica se vuelven extremadamente peligrosos. Esto ha generado una permanente discusión sobre el tema de la transferencia de resistencias de los animales al hombre. En esta discusión el punto central es la utilización de antibióticos a dosis por debajo de las terapéuticas para la prevención de enfermedades o, simplemente para el aprovechamiento de los efectos "productivos" de los antimicrobianos. Sin embargo, este fenómeno de transferencia no es fácil de demostrar, y menos aún, de medir.
Por otra parte una de las piedras angulares de esta discusión ha sido
siempre el origen de estas resistencias: ¿Provienen las mismas de la utilización animal? ¿O provienen del uso en seres humanos? Indudablemente, provienen de ambas partes, en proporciones difíciles de cuantificar.
Es evidente que, a nivel mundial, la utilización de antimicrobianos en
seres humanos dista de ser criteriosa y correcta, la automedicación alcanza niveles alarmantes, la compra de antibióticos sin recetas es habitual en muchos países y, por lo tanto, mientas esto ocurra, la emergencia de resistencias no podrá ser controlada de ninguna manera.
Uso de antimicrobianos en animales de consumo
Algo similar podemos decir de la utilización de antimicrobianos en
explotaciones agropecuarias. Si drogas de grupos químicos y mecanismos de acción similares a las utilizadas en tratamientos humanos, son usados para promoción del crecimiento, a dosis subterapéuticas y durante prolongados períodos de tiempo, tampoco se podrá ejercer ningún control.
Finalmente, y a la luz de los más modernos conocimientos sobre terapia
antimicrobiana, probablemente muchos de los actuales conceptos que hacen a la antibioterapia humana y animal deban ser revistos, a efectos de, efectivamente, transformarla en racional y eficaz.
Clásicamente, desde que el Gobierno de Gran Bretaña formó un comité
para que se expidiera sobre el tema en 1969, se comenzó a proponer que se podría continuar con la utilización de antibióticos como suplementos en los alimentos en el caso que las drogas utilizadas fueran de uso limitado en el hombre, no fueran capaces de inducir resistencias cruzadas con drogas usadas en el hombre y si redujeran el costo de la producción animal. En esa época estas conclusiones dieron lugar a una gran discusión. Como hemos mencionado antes, esta discusión aún continúa, aunque no por el informe en sí, sino porque aún en nuestros días no es globalmente aplicado. Si las conclusiones del informe hubieran sido aplicadas globalmente, posiblemente no hubiéramos padecido el incremento de resistencias que actualmente conocemos, aunque, de ninguna manera se hubiera detenido su avance, que es un fenómeno normal de selección bacteriana frente al uso de antimicrobianos.
14. Formas de uso antibiótico en medicina veterinaria
Los antibióticos son utilizados de diversas formas en medicina veterinaria. Lo que surge como obvio es su utilización en forma terapéutica, para el tratamiento de determinadas enfermedades infecciosas, de la misma manera que en la medicina humana. Sin embargo existen otras formas de utilización: La metafilaxia es una forma de uso que implica el control de ciertas variables clínicas de grupos de animales, hasta que una de ellas, por ejemplo la temperatura, aumenta por encima de determinado valor límite, fijado de antemano. En este caso, todo el lote de animales es tratado para evitar un brote de la enfermedad. La profilaxia, por su parte, implica la utilización de medicamentos para la prevención de enfermedad en animales individuales o grupos de ellos. Finalmente, el uso de antimicrobianos a concentraciones subterapéuticas, que se puede utilizar con objetivos profilácticos y/o de promoción del crecimiento.
Debemos mencionar que la utilización terapéutica y profiláctica también
es rutinaria, en ciertas condiciones, en medicina humana.
Uso de antimicrobianos en animales de consumo
15. El mal uso de antimicrobianos y el desarrollo de resistencias
La emergencia de cepas bacterianas resistentes a antimicrobianos está, obviamente, ligada a la utilización de este tipo de agentes. Es claro, sin embargo, que, si los antibacterianos se utilizaran, en todos los casos, en forma racional, las resistencias serían mucho más raras de lo que, efectivamente, son. Por lo tanto, la mala utilización de antibacterianos es una condición para la emergencia y el desarrollo de resistencias.
15.1 Causas del mal uso de antimicrobianos y su vinculación
con la generación de bacterias resistentes
A continuación se presenta un breve listado de posibles causas de fracaso antibiótico:
15.1.1 Uso de antibióticos cuando no son necesarios: Es algo bastante
frecuente y está estrechamente vinculado con diagnósticos incorrectos. Mucho se ha comentado sobre el hecho de que los veterinarios pueden ser también vendedores de productos, y eso podría tener algún tipo de influencia en los niveles de prescripción dado que la venta del producto es parte de la ganancia del profesional. Sin embargo, pareciera natural que un producto veterinario debe ser vendido por un veterinario, quien está capacitado para asesorar adecuadamente a la persona encargada de los tratamientos. Obviamente el no uso cuando son necesarios también es un problema serio.
15.1.2 No se indica dosis a la persona que aplicará el medicamento. La
dosis queda librada al criterio de la persona a cargo del tratamiento, que en muchos casos no está capacitada para tomar ese tipo de decisiones.
15.1.3 Dosis incorrecta: Puede ser elevada o baja. Si la dosis es
elevada, estando el producto bien seleccionado, lo mismo que los intervalos y la duración del tratamiento, es probable que el problema final sea solamente la pérdida de dinero en droga ineficiente (aunque no debemos descarta los riesgos de toxicidad). El caso de la dosis baja es más problemático. Aquí aún cuando los intervalos sean correctos y la duración del tratamiento también, los riesgos aumentan (además, es difícil que, si la dosis calculada resulta baja, los intervalos sean los correctos). Dependiendo del tipo de droga de que se trate, esa dosis baja repercutirá probablemente en la selección de bacterias resistentes.
15.1.4 Intervalo entre dosis. Si el intervalo es demasiado corto, habrá
una acumulación de droga y los niveles serán demasiado elevados, el tratamiento puede ser exitoso, pero puede haber riesgos de toxicidad y, por supuesto pérdida de dinero en medicamento. Si el intervalo, por otra parte, es demasiado largo, las concentraciones de droga activa caerán por debajo de las necesarias durante un período demasiado largo y eso llevará al fracaso terapéutico.
Uso de antimicrobianos en animales de consumo
15.1.5 Duración del tratamiento. Aquí tenemos un punto realmente
crítico, dado que, si el tratamiento es demasiado largo, corremos el riesgo de seleccionar bacterias resistentes. Por otra parte, si el tratamiento es demasiado corto, seguramente fallará la terapia. Obviamente, e independientemente de los efectos nocivos desde el punto de vista de la selección de resistentes, un tratamiento demasiado prolongado también representará una pérdida de dinero.
15.1.6 Uso de medicamentos de mala calidad. Aún cuando todo lo que
hace a diagnóstico y dosificación sea correcto, si se elige un medicamento de mala calidad, no controlado, no trazable, es muy probable que fracasemos terapéuticamente. Cuando el que se usa es un medicamento de mala calidad, aún en el éxito, no podemos confiar en él, pues si pretendemos usarlo nuevamente en las mismas condiciones, probablemente fracasemos, dado que obtendremos una respuesta diferente. Sobre este tema nos hemos extendido en documentos anteriores que dan pautas generales para la elección de medicamentos por parte de los profesionales, explican las diferencias entre medicamentos que teóricamente son iguales, la importancia de la elaboración bajo normas GMP, la forma de evaluar físicamente un medicamento, la importancia de una buena biodisponibilidad y la comprensión del concepto de bioequivalencia (Errecalde, 1988, 1994, 1995).
15.2 Uso de antimicrobianos en el hombre
En la atención primaria de salud, se puede estimar que entre el 30 y el 60 por ciento de los pacientes de países del tercer mundo recibe antimicrobianos, algo que seguramente está bastante por encima de lo que es realmente necesario (Quick et al, 1997). Las prescripciones innecesarias o dosificaciones inadecuadas o inexistentes son las fuentes de uso incorrecto, algunos ejemplos siguen:
En Tanzania, el 91 por ciento de los antibióticos fueron incorrectamente
prescriptos en su posología (Gilson et al, 1993). En la India, más del 90 por ciento de las prescripciones no especificaban dosis (Uppal et al, 1993). Una fuente frecuente de mala prescripción son las infecciones respiratorias virales, en las que, erróneamente, se prescriben antibióticos. Este es el caso de China, en que 97 de los casos reciben tratamiento indebido (Hui et al, 1997) y de Ghana, en que en el 87 por ciento de los casos ocurre lo mismo (Bosu, W. et al, 1997).
Como comenta Holloway (2000), los médicos aprenden a recetar en los
hospitales, y si éstos recetan mal, los médicos aprenden mal. En hospitales docentes de Canadá, EEUU, Australia, Canadá, Kuwait, Tailandia y Sudáfrica, las prescripciones fueron inadecuadas en porcentajes que se ubicaron en valores muy elevados (Hogerzeil, 1995).
Uso de antimicrobianos en animales de consumo
Entre las causas de mal uso, Holloway (2000) menciona las siguientes: a) Falta de conocimientos o información que conduce a incertidumbre
sobre el diagnóstico y elección del medicamento y temor por la mala evolución del paciente
b) Pedido del paciente. c) Obtención de ganancias por venta de medicamentos.
En los países en desarrollo, quienes prescriben pueden tener escaso acceso a fuentes de información de buena calidad. Muchas veces la única fuente de información la constituyen las empresas farmacéuticas, la información aportada puede estar sesgada en especial en lo que respecta a la eficacia de la droga que se pretende vender en comparación con las de la competencia. La incertidumbre diagnóstica y el miedo a la mala evolución del paciente, y en los países desarrollados, el miedo a los litigios, conducen a la sobreprescripción de antibacterianos (Holloway, 2000).
Cuando quienes prescriben medicamentos no cobran por la consulta sino
por la venta del medicamento, esto representa un problema serio, dado que no solamente hay prescripciones numerosas e innecesarias, sino que, a veces, las prescripciones son de productos muy caros, que hacen que los tratamientos sean incompletos. Por otra parte, la demanda del paciente explícita o no, puede presionar a quien prescribe de manera variada, pero siempre existente (Holloway, 2000).
16. El uso racional de los antimicrobianos
Indiscutiblemente el uso racional de los antimicrobianos es la herramienta fundamental para evitar entrar en la época post-antibiótica. La resistencia a los antimicrobianos un problema que genera preocupación internacional. Las tres organizaciones internacionales que tienen responsabilidades sobre este tema, la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO), la Organización Internacional de Epizootias (OIE) y la Organización Mundial de la Salud (OMS), han mostrado, reiteradamente, su interés en el tema y han producido documentos aportando recomendaciones para la utilización adecuada de este tipo de fármacos.
Estas organizaciones, hasta la fecha han coincidido en una serie de
recomendaciones, reflejadas en publicaciones que abarcan las siguientes áreas:
x Responsabilidad de las autoridades regulatorias y otras con poder de
x Calidad de manufactura. x Marketing, distribución y ventas de este tipo de productos. x Agentes promotores del crecimiento. x Monitorización de resistencia y utilización de antimicrobianos.
Uso de antimicrobianos en animales de consumo
x Uso prudente de antimicrobianos. x Uso profiláctico de antimicrobianos. x Entrenamiento y educación. x Investigación.
Además de la organización de grupos de trabajo, publicación de documentos y difusión de material bibliográfico para conocimiento de técnicos y público en general, estas organizaciones internacionales siguen adelante con su política de aportar soluciones a este tema que, como hemos dicho, es una preocupación mundial.
El uso racional de antimicrobianos es una inquietud de nuestro grupo de
trabajo desde hace muchos años. Hemos publicado diversos documentos y realizado una serie de comunicaciones y conferencias apuntando a la mejora de los criterios de utilización de antimicrobianos en animales. La utilización racional de este tipo de medicamentos en establecimientos productores de leche a efectos de optimizar sus acciones previniendo efectos en la salud pública debe ser una prioridad. Para esto, hemos insistido, a través de diversos documentos y reuniones de entrenamiento, en que se deben poner en práctica planes de administración adecuados, respetándose los períodos de retirada correspondientes a cada formulacióP (Errecalde, 1994, 1996; Mestorino, 2001). Hemos propuesto la utilización de sistemas de HACCP (análisis de riesgos y control de puntos críticos) para la correcta utilización de estos agentes evitando la presencia de residuos indeseables, tema que es tratado en el punto 18 de este mismo trabajo (Errecalde, 2000ª). Hemos insistido en la importancia de la calidad de elaboración y control de antimicrobianos para una terapéutica exitosa y la defensa de la salud pública, considerando que la implementación de procedimientos armonizados en el registro (tal como OIE viene trabajando en América a través del programa CAMEVET), buenas prácticas de manufactura (GMP) en la elaboración de medicamentos y buenas prácticas de laboratorio en el desarrollo y control de los mismos son esenciales y se debe seguir avanzando en ese sentido (Errecalde, 2003).
La terapéutica racional es un terreno dinámico, en que el avance del
conocimiento va volviendo obsoletas las viejas recetas quimioterápicas. Clásicamente, se ha medicado con antibióticos siguiendo planes de administración o regímenes de dosificación, que permitían mantener concentraciones de droga en plasma y tejidos en forma continuada, durante un período suficiente para la total curación de la dolencia. La curación se obtiene por muerte bacteriana de una gran parte de la población y eliminación de los miembros sobrevivientes por activa participación del organismo. De allí que sea tan importante el estado de inmunocompetencia del paciente para la curación. Pacientes inmunodeprimidos necesitan especial cuidado, dado que los quimioterápicos, en este caso, actúan sin la ayuda de las defensas del
Uso de antimicrobianos en animales de consumo
organismo. Hay una serie de consideraciones importantes que hacer para la cabal comprensión de este tema.
16.1 La terapia por encima de la concentración inhibitoria mínima
(CIM)
La concentración inhibitoria mínima ha sido el indicador más utilizado, en terapia antimicrobiana, durante décadas. Se la define como la concentración más baja de droga que previene el crecimiento visible de microorganismos luego de entre 18 y 24 horas de cultivo. Es intuitivamente fácil de concebir que, si un antibiótico se mantiene en el organismo en concentraciones por encima de la CIM para determinada cepa de un microorganismo, será capaz de inhibir el desarrollo de esa bacteria con comodidad. Este concepto ha iluminado el avance de la ciencia durante mucho tiempo. Aunque últimamente, nuevos conceptos cambian las bases de algunos de los conocimientos que veníamos manejando, la CIM continúa siendo un parámetro fundamental, sin cuyo conocimiento no tendríamos posibilidades de éxito en terapia antibacteriana. Por su parte la concentración bactericida mínima (CBM), representa la mínima concentración de antimicrobiano capaz de matar al 99,9 por ciento de los microorganismos inoculados luego de entre 18 y 24 horas de cultivo. Determinados efectos perjudiciales para las bacterias persisten luego que la exposición del microorganismo al antimicrobiano ha terminado. Se llama a esto "efecto post-antibiótico". Aunque el efecto post-antibiótico fue observado hace ya muchos años (Eagle y cols, 1950), más recientemente se descubrió que virtualmente todos los antimicrobianos lo producen en mayor o menor medida.
16.2 Curvas de muerte bacteriana y efectos persistentes de los
antibacterianos
Los efectos antibacterianos pueden ser medidos "in vitro" y aún "in vivo" a través de la exposición de cultivos de microorganismos a diferentes concentraciones de antibióticos, tomando muestras a diferentes tiempos durante un período de 24 horas y determinando la cantidad de bacterias en cada muestra (Vogelman & Craig, 1986). En la Figura 2 se puede apreciar, a modo de ejemplo, una serie de curvas de muerte para una determinada bacteria puesta en contacto con un antibiótico al cual es susceptible a concentraciones iguales, menores y mayores que la CIM de ese antibiótico para esa cepa. Se han desarrollado interesantes modelos en rumiantes, en que suero, líquido tisular normal (obtenido de cajas tisulares) y líquido tisular con estímulo inflamatorio (obtenido de cajas titulares en las que se había inyectado un agente inflamatorio), fueron obtenidos a diferentes tiempos
Uso de antimicrobianos en animales de consumo
luego de la administración de enrofloxacina (una quinolona), para finalmente, inocular esas muestras con una determinada bacteria y determinar su capacidad de sobrevivir o no a las concentraciones de antimicrobiano presentes (Lees & Aliabadi, 2002). Los efectos persistentes, conjuntamente con la capacidad de muerte bacteriana ("killing"), han sido definidos como los mejores parámetros para establecer el óptimo plan de administración de un antimicrobiano (Andes & Craig, 1998). Entre estos parámetros podemos citar el efecto post-antibiótico (PAE), el efecto post-antibiótico sub-CIM (PASME) y el efecto post-antibiótico estimulador de leucocitos (PALE). El PAE es el tiempo necesario para que un cultivo bacteriano que estuvo en contacto con un antibiótico a concentraciones por encima de la CIM y que por lavado o dilución deja de estar en contacto con el antibiótico reinicie el crecimiento. El PAE es un parámetro fundamental, que se incrementa en función de: a. magnitud de la concentración de droga a que la bacteria fue sometida (hablamos de drogas concentración-dependientes), o b. tiempo durante el cual la bacteria estuvo en contacto con el microorganismo a concentraciones por encima de la CIM. Esta es una de las pautas que actualmente se utiliza para la clasificación de antibacterianos por sus efectos, como será visto más adelante. El PASME es mínima cantidad de antibacteriano (por debajo de la CIM) que puede afectar el crecimiento de los microorganismos. Este concepto se comenzó a gestar a partir de la demostración de Lorian (1980), de que concentraciones de antimicrobiano por debajo de la CIM pueden generar cambios estructurales y funcionales en las bacterias. El PALE es un efecto en el cual las bacterias son más susceptibles a la fagocitosis o a la muerte intracelular dentro de leucocitos, cuando se encuentran en la fase post-antibiótica (Odenholt-Tornqvist y cols, 1992).
16.3 Parámetros farmacocinéticos
Desde hace tiempo que se tiene muy en claro la importancia del conocimiento de la farmacocinética de los medicamentos para una terapia eficaz. El uso racional de los mismos se basa, en forma central, en el conocimiento de su farmacocinética, lo que, coordinado con el conocimiento de farmacodinamia y toxicidad, de las características del paciente y la enfermedad, permitirá una terapia óptima. El comportamiento farmacocinético de un determinado compuesto se caracteriza a través de una serie de parámetros. Entre los parámetros farmacocinéticos que más vinculación tienen con la eficacia antibacteriana, no podemos dejar de mencionar la biodisponibilidad, semivida de absorción, área bajo la curva concentración versus tiempo, concentración máxima obtenida en plasma y tiempo al que esa concentración se alcanza, semivida de eliminación y aclaración desde plasma (en general a través de riñón). En la Tabla 4 se
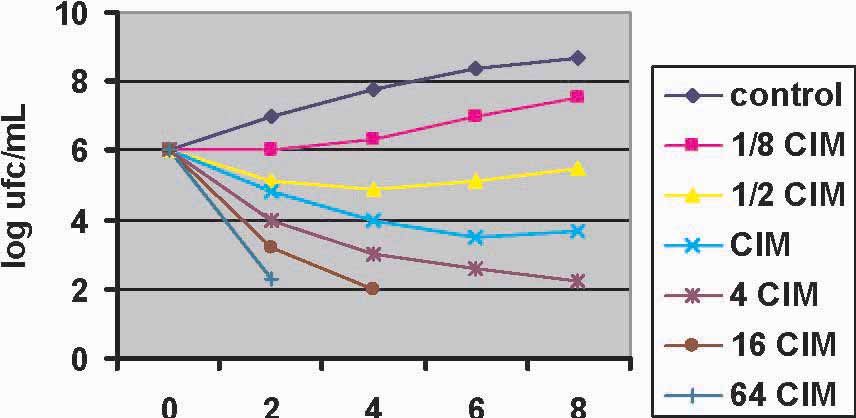
Uso de antimicrobianos en animales de consumo
presentan algunos parámetros farmacocinéticos, su definición, abreviaturas y unidades de medida.
Figura 2: Ejemplo de curvas de muerte para una cepa bacteriana determinada en presencia
de diversas concentraciones de un antibiótico al cual es susceptible. Se puede apreciar como
concentraciones por debajo de la CIM, que teóricamente es la menor concentración que
inhibe el desarrollo, generan un crecimiento menor que el de la cepa en condiciones basales
(produciendo, por lo tanto, algún tipo de inhibición).
16.4 Parámetros farmacocinético-farmacodinámicos
Algunos parámetros farmacocinéticos se pueden correlacionar con parámetros farmacodinámicos, a efectos de obtener predictores más robustos de eficacia terapéutica. En 1968, Wagner, propuso la utilización de la bien conocida ecuación de Hill para correlacionar la intensidad de efectos farmacológicos con las concentraciones de droga existentes en el organismo. El modelo de Wagner tiene fundamento teórico (Goldstein et al, 1974) y empírico (Ariens, 1964). Dahlstrom y cols (1978) y Sheiner y cols (1979) perfeccionan el modelo posteriormente. Un modelo farmacocinético simple, en comparación con un modelo farmacocinético-farmacodinámico simple también, se presentan en la Figura 3. En la Figura 4 se presenta un modelo farmacocinético-farmacodinámico complejo de droga madre-metabolito activo, frente a parásitos susceptibles y resistentes, aplicable a antiparasitarios benzoimidazólicos en tubo digestivo (Errecalde, 2001). En este modelo se puede apreciar lo compleja que puede resultar la modelización farmacocinéticafarmacodinámica.
Uso de antimicrobianos en animales de consumo
TABLA 4. Parámetros farmacocinéticos, su definición,
abreviatura y unidades de medida
Parámetro
Definición
Abreviatura Unidad de
Biodisponibilidad Porción de la dosis administrada que
alcanza el compartimiento central
Tiempo en que se absorbe un 50% de
la dosis administrada
Área bajo la curva Suma de trapezoides y triángulos,
cuyos lados son tiempos o
concentraciones, ubicados por debajo de la curva concentración vs tiempo
La máxima concentración obtenida
humor o tejido en que se midan las
concentraciones de droga
Tiempo al que se alcanza la máxima
concentración en el humor o tejido en
que se midan las concentraciones
Tiempo en que se elimina un 50% de
la concentración existente en plasma
o el humor o tejido en que se determinen las concentraciones
Volumen de humor corporal (por
ejemplo plasma) que es depurado de
la droga estudiada por unidad de tiempo
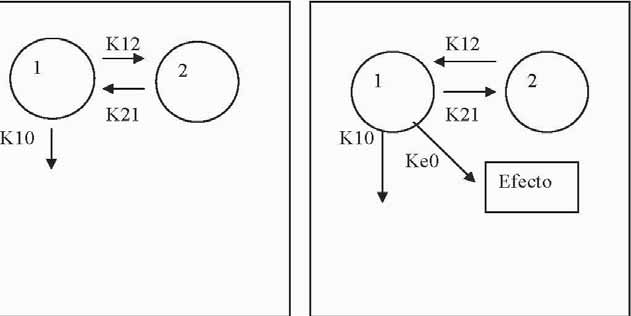
Uso de antimicrobianos en animales de consumo
Figura 3: En la Figura 3 A se puede apreciar la representación esquemática de un modelo
cinético de dos compartimientos, donde 1 y 2 son los compartimientos central y periférico
respectivamente, K12 y K21 las microconstantes de intercambio entre los dos
compartimientos y K10 la constante de tasa de eliminación del organismo. En 3 B, se
observa lo mismo, pero con el agregado de un compartimiento de efecto.
De la integración farmacocinética-farmacodinámica, surgen algunos
parámetros que están resultando de gran utilidad en terapéutica
antimicrobiana. Los parámetros más utilizados son: el área bajo la curva
concentración tiempo dividida por la concentración inhibitoria mínima
(AUC/CIM), la máxima concentración plasmática dividida por la CIM
(Cmax/CIM) y el tiempo en que la concentración del antibiótico excede la
CIM (T>CIM). Estos parámetros son actualmente considerados como
determinantes en la eficacia "in vivo" de los agentes antimicrobianos (Craig,
1998). Cada vez se dispone de más datos sobre experimentos "in vitro" y en
modelos animales que corroboran la importancia de los parámetros
farmacocinético-farmacodinámicos para diferentes antimicrobianos y su
capacidad para permitirnos tratar efectivamente infecciones por gérmenes
con susceptibilidades menores y prevenir la emergencia de resistencias
(Craig, 2001). Los estudios en seres humanos son más limitados, pero
herramientas nuevas o perfeccionadas, como los tiempos de muestreo
optimizados y la farmacocinética poblacional, han mejorado la posibilidad de
estimar el grado de exposición a drogas en pacientes individuales. En la
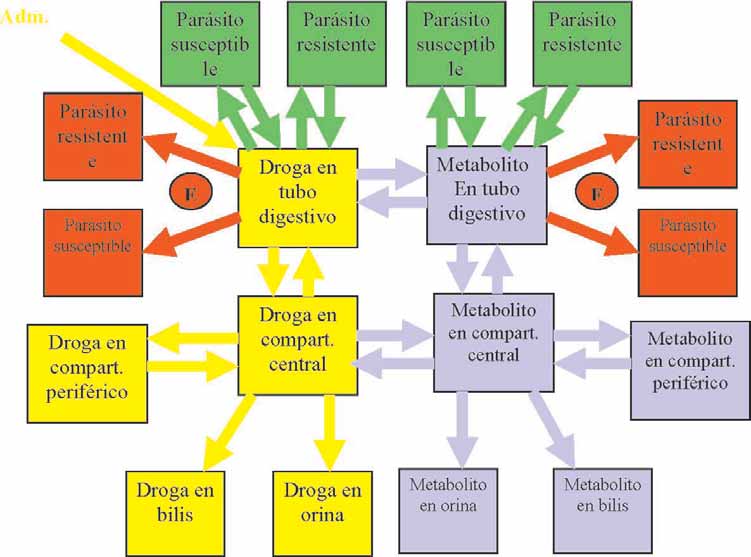
Uso de antimicrobianos en animales de consumo
Figura 5 se puede ver una representación gráfica de estos parámetros. Estos parámetros no son más que el resultado de correlacionar una medida de exposición de la bacteria a la droga (Cmax, AUC), frente a una medida de la potencia del antimicrobiano frente a la bacteria de interés (CIM).
Figura 5: Se observan los parámetros farmacocinéticos concentración máxima (Cmax), área
bajo la curva concentración versus tiempo (AUC), el parámetro farmacodinámico
concentración inhibitoria mínima para la cepa estudiada (CIM) y (con letra más chica y en
amarillo) los parámetros farmacocinético-farmacodinámicos relación máxima concentración
en plasma/concentración inhibitoria mínima (Cmax/CIM), la relación área bajo la
curva/concentración inhibitoria mínima (AUC/CIM) y el tiempo durante el cual las
concentraciones de droga se encuentran por encima de la CIM (t>CIM).
16.5 Tipos de drogas antimicrobianas a la luz de los nuevos
conocimientos
Se puede decir que hay tres tipos de drogas: a) aquellas que muestran una actividad fuertemente dependiente de la concentración; b) aquellas que no muestran esa dependencia y c) aquellas que son solamente bacteriostáticas (Vogelman & Craig, 1986). En la Tabla V se presentan algunos ejemplos de medicamentos con actividades encuadrables dentro de las mencionadas categorías. Obviamente, falta aún mucho trabajo para poder encuadrar a
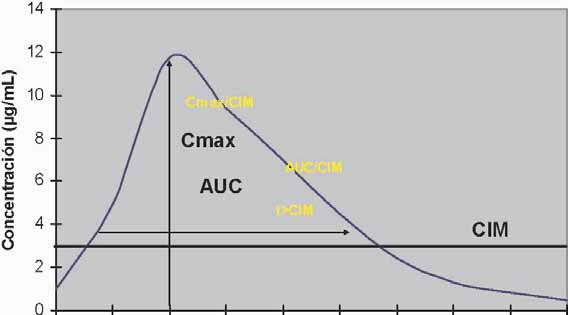
Uso de antimicrobianos en animales de consumo
muchos antimicrobianos. Sin embargo, con los datos que se poseen, se pueden establecer regímenes de dosificación racionales, maximizando eficacia y minimizando los riesgos de emergencia de resistencias.
16.6 Utilización de los parámetros farmacocinético-
farmacodinámicos para evitar la emergencia de resistencias
Es interesante mencionar que de los resultados obtenidos en trabajos llevados a cabo en modelos animales y estudios clínicos en seres humanos, se concluye que la magnitud de los parámetros Pk/Pd no difieren mayormente cuando se salta entre especies. Esto no debería sorprendernos, ya que los receptores para los antimicrobianos se encuentran en la bacteria, que es la misma en humanos o animales. Hay datos que nos sugieren que la magnitud de los parámetros Pk/Pd son similares para diferentes regímenes de dosificación, para diferentes drogas dentro de la misma clase y en diferentes sitios de infección (Leggett y cols, 1991).
tiempo (horas)
Es muy interesante que organismos con susceptibilidad reducida frente a penicilinas, macrólidos y fluoroquinolonas (por disminución de la afinidad a nivel del sitio de unión del antibiótico a la bacteria), necesiten el mismo valor del parámetro Pk/Pd que microorganismos susceptibles para ser completamente eficaces (Woodnut & Berry (1999), Andes & Craig (1999)).
Uso de antimicrobianos en animales de consumo
En el caso de penicilinas y cefalosporinas, el tiempo en que las
concentraciones plasmáticas deben estar por encima de la CIM en un intervalo interdosis es del 40-50 por ciento para una eficacia por encima del 85 por ciento. Para los macrólidos, ocurriría lo mismo (Craig, 2001).
Los aminoglucósidos, por su parte, son drogas cuya eficacia depende
netamente de las concentraciones alcanzadas.
TABLA 5. Clasificación de antimicrobianos en función de sus
actividades relacionadas con las concentraciones que pueden alcanzar
en los sistemas vivos
Parámetro de
actividad **
importancia
Referencia
Concentración
Aminoglucósidos
dependiente
Fluoroquinolonas
Craig y cols (1991)
Beta lactámicos
dependiente
Leggett et al (1989)
dependiente
Tetraciclinas* Glicopéptidos Quinupristina dalfopristina
Son medicamentos predominantemente bacteriostáticos.
Estos tipos de actividad han sido recientemente clasificados por Andes & Craig (1998) como tipo
I, II y III para las drogas de acción concentración dependientes, tiempo dependientes con mínima persistencia y tiempo dependientes con persistencia prolongada.
17. Los costos de la resistencia en medicina humana y
veterinaria
El problema de la resistencia en medicina humana se centra en pacientes críticos, esto es inmunodeprimidos, niños, ancianos, o pacientes con problemas cinéticos (dializados, etc.) Cuando un patógeno multi-resistente ataca a un paciente con alguna de las características citadas, los antibióticos normalmente usados no funcionan y hay que trabajar con las drogas más nuevas y, por supuesto, más caras. En el caso de tener éxito, siempre será un éxito muy oneroso. Obviamente, el fracaso de la terapia puede llevar a la muerte del paciente.
En el caso de la medicina veterinaria, la cosa no es tan clara dado que la
farmacovigilancia sobre fallos de actividad antibiótica en tratamientos
Uso de antimicrobianos en animales de consumo
veterinarios atribuibles a resistencias microbianas es escasa, aún en los países centrales.
18. Análisis de riesgos y control de puntos críticos, una nueva
herramienta
El control alimentario clásicamente ha contribuido a combatir los efectos de los problemas producidos por fallas de elaboración, pero no sus causas. Ante esta aseveración, y frente a potenciales problemas se presentaban dos alternativas: Intensificar los controles o hacer una reingeniería del sistema con todo lo que ésta implicaba. El análisis de riesgos y control de puntos críticos (HACCP) es el resultado de la reingeniería del sistema.
El concepto del sistema HACCP se desarrolló en la década del 60 por la
necesidad de la Agencia Espacial Norteamericana (NASA) de controlar los alimentos que iban a ser consumidos por los astronautas.
En 1991 la FDA inicia un sistema de control voluntario de alimentos
basado en HACCP para productos pesqueros. Este sistema se basó en la ausencia de todo tipo de contaminación a lo largo de todo el proceso de elaboración, en lugar de controlar solamente el producto final y estaba muy vinculado con el que anteriormente había desarrollado la NASA.
El HACCP consta de siete etapas:
a. Identificación de riesgos potenciales. b. Determinación de puntos críticos de control. c. Establecimiento de límites críticos. d. Instalación de sistemas de monitorización. e. Generación de acción correctiva cuando los límites son sobrepasados. f. Llevado de registros. g. Verificación periódica del sistema para asegurar su funcionamiento normal.
En 1993 se comenzó a aplicar en Estados Unidos el programa de aseguramiento de la calidad lechera. En concordancia con la preocupación de los consumidores por los residuos químicos en leche, la Asociación Veterinaria Americana y la Federación de Productores de Leche generaron, aplicando el concepto de HACCP, un protocolo a ser seguido por los establecimientos tamberos con el objetivo de mejorar las prácticas terapéuticas, evitando la presencia de residuos de medicamentos en leche y sus subproductos.
El protocolo se basa en diez puntos críticos de control, a saber:
a. Buenas prácticas de manejo de los animales (alojamiento,
alimentación, reproducción, vacunación, control de parásitos y control de mastitis).
Uso de antimicrobianos en animales de consumo
b. Establecer una excelente relación veterinario-cliente-paciente. c. Utilizar solamente drogas aprobadas, prescriptas por un
d. Asegurarse que los medicamentos utilizados tengan etiquetas de
acuerdo con las regulaciones vigentes.
e. Almacenar las drogas en forma correcta. f. Administrar las drogas correctamente e identificar los animales
g. Mantener registros adecuados de animales tratados. h. Usar tests de screening de drogas en leche. i. Educar y entrenar al personal a cargo de la administración de
medicamentos a los animales.
j. Reunirse con el veterinario una vez al año a efectos de evaluar la
marcha de este protocolo.
Se trata de un excelente antecedente para comprender la importancia que los sistemas de HACCP pueden tener en el incremento de la calidad de los sistemas de producción primaria. Aunque en estos sistemas no es tan fácil determinar donde se encuentran los puntos críticos y cuales son los límites críticos (comparativamente con lo que ocurre en un proceso industrial, dado que trabajamos con animales y no con máquinas), el diseño de los mismos permite una monitorización mucho más precisa del proceso productivo a efectos de prevenir la aparición de residuos en concentraciones indeseables.
El momento de decisión de aplicación de un tratamiento antibiótico, es
de fundamental importancia y la decisión debe ser tomada de la forma más objetiva y correcta posible. El ejemplo anterior es elocuente en lo que hace a la mejora del proceso de acciones dirigidas a la terapia del animal productor de leche. A ese ejemplo, hay que sumar las Guías para las Buenas Prácticas del Tambo, editadas por FAO (2004), en las que se hace una extensiva revisión del manejo del tambo en base a buenas prácticas agrícolas (GAP), se trata de un excelente documento que provee las bases para una óptima explotación, contemplando todos los aspectos productivos. Con la experiencia de varios años trabajando en el incremento de la calidad de los procesos de administración de medicamentos en explotaciones primarias, hemos diseñado un sistema de control de puntos críticos para la toma de decisión, seguimiento, monitorización, registro y control de los tratamientos veterinarios por médicos veterinarios, que consta de los siguientes pasos
(Errecalde, 2000ª, 2000 ):
I. Correcto manejo preventivo: Esto implica no solamente la
aplicación de vacunas que el programa sanitario seguido requiere, sino el aporte de los alimentos, minerales y microelementos necesarios para el crecimiento/rendimiento normal. Un correcto manejo preventivo es la mejor herramienta para la disminución en la
Uso de antimicrobianos en animales de consumo
utilización de antimicrobianos. Las Guías de FAO para las Buenas Prácticas del Tambo (2004) son muy ilustrativas a este respecto.
II. Ante la presentación de un cuadro infeccioso, se deberá tomar la
decisión: ¿Tratar o no tratar? Esto depende de varios factores, pero
fundamentalmente se trata de un recordatorio de que no se debe tratar
automáticamente ante cualquier manifestación de presunta infección.
Determinar si efectivamente, se trata de una infección, si es una
infección tratable con antimicrobianos, y evaluar, desde el punto de
vista económico, el costo del tratamiento, las posibilidades de éxito,
versus el costo de no tratar o descartar el animal.
III. Si la decisión es tratar, el punto crítico es: Elección del
tratamiento. Para esto: ¿Haremos análisis de laboratorio o trataremos
a ciegas? Se debe dejar claramente establecido que tratar a ciegas no
es algo impropio. Simplemente definimos de esa manera al
tratamiento en base a hipótesis, con diagnóstico exclusivamente
clínico y sin resultados de análisis de laboratorio. Si tenemos pruebas
de laboratorio, esto es un aislamiento, identificación y antibiograma
del microorganismo actuante, podremos hacer una elección muy
racional de la droga a administrar. Si además tenemos resultados de
concentración inhibitoria mínima de la droga al agente etiológico,
mucho mejor, podremos diseñar una terapia óptima en base a dosis,
intervalo entre dosificaciones y tiempo de tratamiento. Por otra parte,
si decidimos tratar a ciegas, deberemos considerar una serie de
factores: En base a la historia clínica del animal y la historia
epidemiológica del establecimiento y de la zona (ambas cosas
requieren una exhaustiva anamnesis), nivel de inmunocompetencia
del animal, presunción de flora mixta, farmacocinética del agente
seleccionado, estado corporal general del animal (grasa corporal) y
funcionamiento hépato-renal, mencionando solamente y a modo de
ejemplo algunos de los más importantes, podremos instituir una
terapia racional.
IV. La dosis, intervalo entre dosis y duración del tratamiento con
el/los agentes seleccionados. Una vez elegido el/los agentes a utilizar, deberemos decidir sobre dosis, intervalo entre dosis y duración del tratamiento. Esto está estrechamente vinculado con la farmacocinética del agente seleccionado y con la farmacodinamia del mismo frente al microorganismo actuante. En términos generales y simplificando el problema, podríamos decir que en función de la liposolubilidad del agente antimicrobiano, este se comportará de una u otra manera, y esto puede condicionar las características del tratamiento. Si bien clásicamente se ha insistido sobre la necesidad de ubicar las concentraciones del fármaco antimicrobiano siempre por encima de la CIM frente al microorganismo actuante, este concepto está en
Uso de antimicrobianos en animales de consumo
profunda revisión. Actualmente, con el grupo de antibióticos concentración dependientes (aminoglucósidos, quinolonas), es mucha más importante la relación Cmax/CIM que el tiempo que las concentraciones de droga se encuentren por encima de la CIM. Con una relación Cmax/CIM mayor de 8, estaremos seguros de que la droga está ejerciendo el máximo de su acción antimicrobiana y el máximo de su efecto post-antibiótico. No es demasiado importante el intervalo entre dosis, dado que estos agentes funcionan, en general con una dosis diaria. Son drogas con gran residualidad terapéutica (efecto post-antibiótico). Por otra parte, al tratarse de drogas tiempo dependientes (beta lactámicos, macrólidos, clindamicina), el tiempo que la concentración de la droga se mantiene por encima de la CIM pasa a ser más importante que el nivel en que la supere (no es necesario que la concentración supere la CIM en más de 2 a 4 veces) y es suficiente que la concentración supere la CIM en aproximadamente un 50 por ciento del período entre dosis. Se trata de drogas con poca residualidad terapéutica. El caso de las tetraciclinas, azitromicina y glucopéptidos es interesante porque si bien son tiempo dependientes, tienen persistencias terapéuticas prolongadas (Craig W, 2001).
V. Administrar el medicamento correctamente: Elegir la vía de
administración adecuada, lo que significa considerar las características generales de la molécula, si es liposoluble o hidrosoluble, su formulación (oleosa, acuosa, etc.), esterilidad del equipamiento, equipo adecuado para el tipo y vía de administración que se haya seleccionado, lugar adecuado para la vía de administración seleccionada en la especie que se va a tratar, limpieza y antisepsia de la zona de administración, lo que requiere una buena selección del agente antiséptico.
VI. Usar solamente medicamentos de excelente calidad, aprobados por
las autoridades competentes y prescriptos por un veterinario.
VII. Identificar los animales tratados. Esto siempre fue considerado de
particular importancia en explotaciones tamberas, en que es imprescindible que el animal tratado no sea ordeñado junto con los otros, porque, en ese caso, una gran cantidad de droga pasara a industrialización y consumo. Sin embargo, con la implementación de los sistemas de trazabilidad, la identificación de animales se está transformando en una práctica crucial, que deberá ser rigurosamente cumplida. Esto es de enorme ayuda, especialmente en el momento de enviar animales a faena, para evitar la confusión y la llegada de animales en período de restricción al circuito de consumo.
VIII. Clasificar y guardar todas las drogas correctamente. El encargado
de la compra y traslado, deberá hacerse asesorar por el vendedor,
Uso de antimicrobianos en animales de consumo
fabricante, o leyendo atentamente las instrucciones del producto sobre temperaturas de conservación y eventuales cuidados especiales para el traslado y mantenimiento. Deberá almacenarlo correctamente, en el lugar adecuado y predeterminado. Adecuado en cuanto a humedad, temperatura e iluminación, correcto en cuanto al lugar determinado de antemano para ese tipo de drogas (por ejemplo, si se tratara de un producto para el secado terapéutico de vacas lecheras, se lo deberá almacenar en el estante/zona de antibióticos, claramente diferenciado de los productos dedicados a vacas en lactación). Se trata de algo esencial, porque no siempre, o en realidad, casi nunca, es el veterinario el que se encarga de seleccionar el medicamento de la farmacia veterinaria del establecimiento para su administración. Entonces, se deberán extremar los cuidados para favorecer el correcto manejo y evitar todos los errores fácilmente evitables a través de un sistema de inventario y almacenamiento adecuado.
IX. Mantener registros individuales de cada animal a lo largo de toda
su vida. En esos registros constarán todos los medicamentos administrados, día y hora de administración, dosis, intervalos, repeticiones, éxitos o fallos de tratamientos, efectos inesperados o indeseables, períodos de retirada, etc. Los registros deberían ser diseñados por el veterinario de la empresa y se trataría de planillas "ad hoc", en las que no debería omitirse ninguno de los datos que hacen al control medicamentoso y de potenciales residuos. Trabajando con planillas adecuadas a los actuales sistemas de trazabilidad, todo quedaría cubierto.
X. Educar a todos aquellos involucrados en el manejo de
medicamentos veterinarios. Parece algo obvio que los veterinarios
en el mundo no alcanzan para estar presentes en todas las granjas,
establecimientos, etc., en que animales deben ser tratados con
antibióticos. Es por eso que la persona que administra el
medicamento veterinario, cuando no es un veterinario, debe estar debidamente entrenado. Y no solamente aquel que los administra. Desde el encargado del transporte y almacenamiento, hasta el que lo aplica, el que controla efectos y resultados, llegando al que dispone de los envases vacíos, todos, deben recibir entrenamiento adecuado. En el punto 5 se habla de la correcta administración, por lo que aquí no insistiremos con ello. Sin embargo, educarlos y entrenarlos correctamente, es un proceso íntimamente vinculado con el éxito de las terapias instituidas, con la ausencia de residuos indeseables en los productos comestibles que surjan del sector primario al que el establecimiento pertenece, con la protección de los operadores y con la debida protección del medio ambiente.
Uso de antimicrobianos en animales de consumo
XI. La aplicación generalizada de un sistema como el propuesto, en que
se administre un medicamento solamente luego de haber recorrido todos los pasos detallados, no solamente va a representar una enorme mejora de los resultados terapéuticos, sino que va a impactar directamente en la cadena de la seguridad, que definimos como: la seguridad del paciente, en primer lugar, la seguridad del operador en segundo, la seguridad del consumidor, en el tercero, y, finalmente, pero no menos importante, la seguridad del medio ambiente.
19. ¿Hacia donde va la resistencia bacteriana?
En varios de los párrafos precedentes, hemos insistido sobre el hecho de que la resistencia bacteriana sigue al uso de antibióticos, y que estos últimos son los que seleccionan los microorganismos resistentes y, probablemente, les permiten sobrevivir. Sin embargo, como también ha quedado reflejado más arriba, otros autores mencionan la existencia de factores de resistencia en las bacterias previamente a la era antibiótica. Se ha reportado disminución de los casos de resistencias a vancomicina luego de la prohibición del uso de avoparcina como promotor del crecimiento. Indudablemente es complicado mantener la objetividad en un terreno plagado de pasiones e intereses como el que nos ocupa. Pero no debemos dejar de escuchar a aquellos que nos dicen que la evolución de la resistencia no es, necesariamente, la otra cara de la moneda de la evolución de la susceptibilidad; y que disminuir el uso de antimicrobianos podría no reemplazar un cambio fundamental en diseño de medicamentos para evitar la evolución de resistencias y favorecer la evolución de microorganismos susceptibles (Heinemann, et al 2000).
Es evidente que, con los datos de que disponemos actualmente, no
podemos asegurar que la limitación en el uso de antimicrobianos vaya a revertir las actuales resistencias, ni siquiera que vaya a detener la evolución de las bacterias hacia la resistencia antibiótica. Parece extremadamente claro que necesitamos de estudios coordinados en diferentes partes del mundo con la misma metodología, y que la monitorización del proceso de desarrollo o reversión de resistencias, en función del tiempo, nos dará el conocimiento necesario para tomar las decisiones adecuadas.
¿Se debe suspender el uso de antimicrobianos como
promotores del crecimiento?
Desde hace tiempo se ha instalado una discusión internacional sobre la conveniencia y la factibilidad de dejar de utilizar antibióticos con fines de promoción del crecimiento. Estos medicamentos son utilizados en dosificaciones bajas, subterapéuticas, en alimentos animales, a los efectos de
Uso de antimicrobianos en animales de consumo
mejorar la calidad del producto final (una menor proporción de grasa y una mayor proporción de proteínas). Otro beneficio de la utilización de estas drogas en la dieta es el control de patógenos zoonóticos, como Salmonella, Campylobacter, E. coli y enterococos. Por otra parte, hay quienes argumentan que la utilización de cualquier antibiótico en estas condiciones favorece la selección de resistencia en bacterias patógenas, limitando, en consecuencia su utilización en casos clínicos.
Muchas han sido las teorías que tratan de explicar el efecto de los
antibióticos como promotores del crecimiento. Lo que es indudable es que su efecto está vinculado a la intensificación de la explotación productiva. Se ha pensado en que estos medicamentos pueden suprimir parte de la población bacteriana intestinal que pueden llegar a consumir hasta un 6 por ciento de la energía neta en cerdos (Jensen, 1998). Controlando la población bacteriana, probablemente la pérdida energética sea menor. Thomke & Elwinger (1998), sugieren que las citokinas liberadas durante el proceso inmune estimulan la liberación de hormonas catabólicas que reducirían la masa muscular. Obviamente, una reducción de las infecciones intestinales actuaría en contrario. El efecto de los antimicrobianos sobre bacterias anaerobias puede ser otra explicación (los anaerobios son raramente buscados), esto podría prevenir enfermedades como las enteritis necrotizantes e incluso, al suprimir bacterias capaces de producir exotoxinas, evitar los efectos de éstas.
Independientemente de la teoría que se quiera utilizar, parece innegable
que el resultado de la utilización de promotores del crecimiento redundará en aumentos diarios de peso en el rango de 1 a 10 por ciento con carnes de mejor calidad.
El que se trate de un tema tan conflictivo, explica, de alguna manera, las
diferencias en la utilización de este tipo de drogas en áreas desarrolladas del mundo, así podemos ver, en la Tabla 4 cuales son las drogas que se han utilizado en la Unión Europea y se han ido prohibiendo paulatinamente y en la Tabla 5 cuales son las drogas que se utilizan en los EE.UU. Este es un ejemplo extremo de diferencias entre países desarrollados. Mientras, por un lado, los EE.UU. utilizan extensivamente una gran cantidad de antimicrobianos como promotores del crecimiento (algunos considerados de importancia en clínica humana), por el otro, Suecia, no utiliza actualmente antibióticos con los mismos propósitos. En 1995 el Parlamento sueco prohibió la utilización de antibióticos con fines de promoción del crecimiento. Si bien con un costo en pérdidas productivas importantes, y con mayores costos en instalaciones y manejo, Suecia ha demostrado que se puede producir carne en forma moderna sin utilizar promotores del crecimiento antibacterianos. El Animal Health Institute of America (AHI, 1998), por su parte, considera que, sin la utilización de antimicrobianos como promotores del crecimiento, los EE.UU. necesitarían 452 millones de pollos, 23 millones de bovinos y 12 millones de cerdos extra, para alcanzar los
Uso de antimicrobianos en animales de consumo
niveles de producción que se alcanzan con las prácticas actuales. En el resto de la Unión Europea, en que el uso de antimicrobianos como promotores del crecimiento es más limitado, pero continúa en vigencia, la mortalidad como consecuencia de alteraciones intestinales está en un 10-15 por ciento por debajo que en países como Suecia, que no los utiliza. A esto hay que agregar diferencias en ganancias de peso y calidad de carnes. En párrafos anteriores mencionamos la experiencia llevada cabo en Dinamarca (documento WHO), en que se suspendió la utilización de antimicrobianos para la promoción del crecimiento en cerdos y aves. La conclusión de ese documento fue que, en condiciones similares a las de Dinamarca, el uso de antimicrobianos con el único propósito de promoción del crecimiento podría ser discontinuado, sin efectos colaterales demasiado complicados. Aquí debemos remarcar las palabras "en condiciones similares a las de Dinamarca", dado que esas condiciones son, en realidad bastante difíciles de cumplimentar, especialmente en los países del tercer mundo. Las medidas profilácticas implementadas en Dinamarca, permitieron que el programa fuera exitoso con pérdidas mínimas en producción porcina y prácticamente sin pérdidas en explotaciones avícolas. Las pérdidas, según el informe serían completamente compensadas por el aumento de confianza del consumidor en los productos producidos bajo el nuevo sistema y por el valor agregado de las exportaciones danesas. Los expertos concluyen que la experiencia danesa es extrapolable a otros países en similares condiciones de desarrollo agropecuario. Esto significa: elevada intensidad, bioseguridad, alojamiento cerrado y muy elevado estándar sanitario. Es extremadamente discutible la última conclusión del trabajo, en que asegura que: "a la vista de los resultados obtenidos en Dinamarca, es poco probable que una acción similar en países en desarrollo pueda disminuir la producción total de carne". Nosotros pensamos que, desde el punto de vista sanitario, muchas explotaciones tercermundistas no están en condiciones mínimas de resistir un proyecto como el mencionado. Por otra parte, parece lógico pensar que debemos luchar contra las resistencias bacterianas con las armas más adecuadas, pero que esa lucha no debería basarse en una pérdida de productividad en regiones del globo en que cada gramo de alimento es esencial para paliar el hambre. Por lo tanto, en las actuales condiciones, deberá dedicarse mucho al desarrollo económico, técnico y cultural de ciertas partes del globo, antes de pretender enrolarlos en programas de mejoramiento de la calidad alimentaria que obedezcan a políticas de mejora de la salud pública global.
Uso de antimicrobianos en animales de consumo
TABLA 4. Promotores del crecimiento en Europa
Prohibido desde
TABLA 5. Promotores del crecimiento utilizados en EEUU clasificados
por especie animal.
Clortetraciclina
Clortetraciclina Clortetraciclina
Tiamulina Virginiamicina
21. ¿Existen alternativas al uso de antibióticos como promotores
del crecimiento?
Cuando se considera la prohibición del uso de antimicrobianos como promotores del crecimiento, se debería considerar paralelamente cuales son las posibles medidas a tomar como alternativas.
Una alternativa lógica sería la de desarrollar drogas con mecanismos de
acción similares, lo que no sería más que el descubrimiento de nuevos antimicrobianos con mecanismos de acción diferentes de los críticamente importantes en clínica médica humana. Una ruta más compleja sería el mejoramiento de la sanidad animal. Esto es algo elemental. Fue descripto por Prescott y Bagot (1993), que los promotores del crecimiento funcionan mejor cuanto peores sean las condiciones sanitarias. Pero el mejoramiento de la salud animal no es algo fácil de conseguir, especialmente cuando las
Uso de antimicrobianos en animales de consumo
condiciones económicas y sanitarias generales correspondientes al país no se condicen con ello.
Una de las alternativas que se manejan corrientemente son las enzimas,
que adicionadas a las dietas de pollos y cerdos, mejoran el nivel de digestión de ciertos componentes, incrementado sustancialmente el nivel de aprovechamiento de los nutrientes.
Los probióticos están siendo utilizados de manera variable desde hace
tiempo ya. Los probióticos son microorganismos que se incluyen en la dieta o son administrados por otras vías. Consisten en microorganismos o mezclas de los mismos que se comportan de manera "amistosa" con el organismo. Sus mecanismos de acción están en discusión, pero, resumidamente se podría decir que podrían seguir una o más de las siguientes acciones: a. Actuar en función del principio de exclusión competitiva, en que una bacteria a grupo de ellas coloniza el intestino de un paciente, con lo que evita que un patógeno pueda ocupar lo que ya está ocupado. b. Actuar estimulando el sistema inmune del paciente. c. Actuar influenciando el metabolismo intestinal, haciéndolo más eficiente.
Pese a sus teóricas ventajas y a varias demostraciones de eficacia, la
actividad de los probióticos sigue generando dudas en la comunidad científica. Entre los hechos favorables, se puede citar que calostros fermentados pueden inhibir el desarrollo de tumores en ratones (Shahani y cols, 1983). Por su parte, Kato y cols (1985) confirmaron que Lactobacillus casei es capaz de inhibir el desarrollo de tumores. Sin embargo, Sharpe y cols (1973) comunicaron que Lactobacillus casei rhamossus puede producir endocarditis y abscesos en animales. Una de las dudas más grandes que actualmente persisten respecto de la utilización de probióticos, son los riesgos potenciales involucrados en la transferencia de resistencia antibiótica y factores de virulencia crípticos.
Las medidas de manejo que se puedan implementar siempre repercutirán
favorablemente en la productividad. En Australia se ha trabajado sobre el sistema llamado "todo adentro, todo afuera", lo que significa que cuando se establece un movimiento en la granja, este es total y no quedan animales en la misma, evitando infecciones cruzadas. Si bien esto es generalmente aplicado en explotaciones avícolas, en explotaciones porcinas se trata de algo más complicado y novedoso, que seguramente una vez implementado generará beneficios.
Los planes de vacunación, por su parte, tampoco pueden ser discutidos y,
más allá de los costos involucrados, sus resultados sueles ser satisfactorios.
Sin embargo, pareciera que, por el momento, no aparece una opción
realista para suplantar a los antibacterianos como promotores del crecimiento.
Uso de antimicrobianos en animales de consumo
22. La higiene como barrera para la prevención de la
diseminación de resistencias
Hemos aclarado anteriormente que las resistencias microbianas de origen no-humano llegan al hombre directamente a través de bacterias que han emergido como resistentes en animales que han sido tratados con antibióticos, o a través de determinantes genéticos de resistencia que, en algún punto de la cadena alimentaria, saltan y son tomados por bacterias patógenas para el hombre. En todos los casos es necesario un íntimo contacto de las bacterias animales y las humanas. Si bien hemos insistido cuando se habló de la epidemiología de la resistencia de la multiplicidad de vías a través de las cuales las bacterias humanas y animales pueden entrar en contacto, debemos dejar claro aquí, que la vía del contacto con alimentos es fundamental. Es por ello que insistiremos en que el manejo higiénico de los alimentos, base fundamental de la prevención de las enfermedades transmitidas por alimentos, es crucial en este tema. La Organización Mundial de la Salud ha trabajado fuertemente y desde hace tiempo sobre esto, habiendo elaborado las "Reglas de Oro" para la preparación higiénica de los alimentos. Por tratarse de reglas de extrema trascendencia, las transcribiremos:
a. Elegir alimentos tratados con fines higiénicos. La
pasteurización de la leche es un ejemplo prácticamente universal. La irradiación de pollos, es algo más complejo, pero extremadamente válido. El tratamiento de los alimentos es no solamente para que se mantengan mejor y por más tiempo sino para que sean más seguros. Aquellos alimentos que poseen gran valor alimentario cuando están crudos, como algunas verduras, deben ser cuidadosamente lavadas antes de ser consumidas.
b. Cocinar bien los alimentos. Muchos alimentos crudos (leche no
pasteurizada, pollos, carnes rojas) están a menudo contaminados con bacterias patógenas. Estas pueden eliminarse si se cocina bien el alimento. Esto significa al menos 70ºC en toda la masa de alimento.
c. Consumir inmediatamente todos los alimentos cocinados.
Dado que cuando los alimentos se enfrían los microorganismos comienzan a proliferar nuevamente, conviene consumir lo cocinado en forma inmediata.
d. Guardar cuidadosamente los alimentos cocinados. Si se quiere
tener en reserva alimentos cocinados, es conveniente tenerlos calientes por encima de 60*C o fríos por debajo de 10ºC. En el caso de los alimentos para lactantes lo ideal es no guardarlos ni poco ni mucho.
Uso de antimicrobianos en animales de consumo
e. Recalentar bien los alimentos ya cocinados. Esta es la mejor
protección contra los microorganismos que hayan proliferado durante el almacenamiento (también aquí es importante que todo el alimento alcance los 70ºC.
f. Evitar el contacto entre alimentos crudos y cocinados. Aquí
hay que tener cuidado pues no solamente se trata de evitar el contacto de, por ejemplo carne de pollo cruda con alimento cocinados, sino de evitar utilizar los utensilios (tablas, cuchillos y tenedores) que se usaron para cortar carne cruda, para cortar la comida ya cocinada.
g. Lavarse las manos a menudo. Hay que lavarse bien las manos
antes de iniciar la preparación de alimentos y luego de cualquier interrupción, especialmente si fue para cambiar a un bebé o para ir al baño. Si se ha estado manipulando alimentos crudos como carnes rojas, pollos o pescados, habrá que lavarse bien las manos antes de manipular otros alimentos, especialmente si ya están cocinados.
h. Mantener escrupulosamente limpias todas las superficies de la
cocina. Todo lo que queda sobre las mesadas puede estar
contaminado con gérmenes. Y los alimentos se contaminan con
facilidad cuando se colocan en mesadas no debidamente
higienizadas. Por cierto que todos los paños o esponjas usados en
la cocina deben ser lavados diariamente (en algunos casos se
recomienda hervirlos).
i. Mantener todos los alimentos fuera del alcance de insectos,
roedores y otros animales. Todos los animales son vectores de
patógenos capaces de generar enfermedades alimentarias. La
mejor medida de protección es el almacenamiento en recipientes
herméticos.
j. Utilizar agua pura. El agua pura en tan importante para cocinar
como para beber. Si no hay confianza en el agua, conviene hervirla antes de usarla. En el caso de los lactantes esto es crucial.
Si estas reglas fueran respetadas en forma generalizada, probablemente representarían un golpe muy duro a la transmisión de resistencias bacterianas de los animales al hombre. Lo que ocurre es que no solamente hay que tener un determinado grado de instrucción para poder aplicarlas, sino que en ciertas regiones del globo hablar de "mantener limpia la cocina" es absurdo porque no hay, en el lugar que se habita, un ambiente a ser utilizado como cocina.
Uso de antimicrobianos en animales de consumo
23. El futuro
Pareciera evidente que para evitar entrar a la "era post-antibiótica", no van a ser las prohibiciones de utilización la llave. Las prohibiciones no harán más que reducir la productividad a niveles alarmantes en regiones del planeta que las necesitan elevadas, aumentar el mercado negro y las fabricaciones ilegales y carentes de todo control, el contrabando y la pérdida de control sobre el flujo de antimicrobianos en el mundo, lo que, paradójicamente, puede impactar negativamente en los niveles de resistencias bacterianas.
El uso racional de los antimicrobianos, por veterinarios bien formados en
el tema cuando eso es posible, o por técnicos entrenados en su uso, en otros casos, con instrucciones concretas para la utilización de productos farmacéuticos de elevada calidad, es la única y clara salida para el problema que nos ocupa. Para ello, se deberán destinar recursos a la investigación básica y aplicada, especialmente vinculada a aspectos de la farmacocinética y la farmacodinamia de los antibacterianos, a la investigación clínica de sus efectos y, especialmente a la educación y entrenamiento de todos aquellos involucrados en la elaboración, comercialización, utilización, fiscalización y control de los productos fabricados en base a antibióticos.
Uso de antimicrobianos en animales de consumo
Acar, J.F., O'Brien, T., Goldstein, F. & Jones, R. 1993. The epidemiology
of bacterial resistance to quinolones. Drugs. 14 suppl. 3:24-28.
Andes, D. & Craig W. 1998. In vitro activities of amoxicillin and
amoxicillin-clavulanate against Streptococcus pneumoniae: application to breakpoint determination. Antimicrob. Agents Chemother. 42:2375-2379.
Andes, D. & Craig W. 1998. Pharmacokinetics and pharmacodynamics of
outpatient intravenous antimicrobial therapy. Infect. Dis. Clin. N. Am. 112:849-860.
Animal Health Institute, USA. 1998. Antibiotics resistance back in the
news. AHI Quarterly, 19: 1-4.
Ariens, E. J. 1964. The mode of action of biologically active compounds. In:
Stevens G.D. Ed: Molecular Pharmacology. New York. Academic Press. Pp. 136-148.
Bergeron, M. & Oulette, M. 1998. Preventing antibiotic resistance through
rapid genotypic identification of bacteria and their antibiotic resistance genes in the clinical microbiology laboratory. J. Clin. Microbiol. 36:2169-2172.
Bogaard, A., Van Mertens, P., London, N. & Stobberingh, E. 1997. High
prevalence of colonization with vancomicin and pristiniamycin resistant enterococci in healthy persons and pigs in the Netherlands: is the addition of antibiotics to blame? J. Antimicrob. Chemother.40:454-456.
Bosu W., et al 1997. East African Medical Journal. 74(3):138.
Burns, J. 1995. Mechanisms of bacterial resistance. Pediatr. Clin. North
America. 42:497-507.
Craig, W., Redington, J. & Ebert, S. 1991. Pharmacodynamics of amikacin
in vitro and in mouse tight and lung infection. J. Antimicrob. Chemother. 27(Suppl. C):29-40.
Craig, W. 1997. Postantibiotic effects and the dosing of macrólidos, azalydes
and steptogramins. In: Zinner S, Young L, Acar J, Neu H, Editors. Expanding indications for the new macrolides, azalides and streptogramins. New York, Marcel Dekker. Pp27-38.
Craig, W. 1998. Pharmacokinetic-pharmacodynamic parameters: rationale
for antibiotic use in mice and men. Clin. Infect. Dis. 26:1-12.
Craig, W. 2001. Does the Dose Matter? Clin. Infect. Dis. 33(Suppl. 3):S233-
Dahlstrom, B., Paalzow, L. & Segre, G. 1978. Relationship between
morphine pharmacokinetics and analgesia. J. Pharmacokinet. Biopharm. 6:41-53.
Uso de antimicrobianos en animales de consumo
Davies, J. 1994. Origin, acquisition and dissemination of resistance genes.
Science 264:375-382.
Tagle, H., Fleischman, R. & Musselman, A. 1950. Effect of schedule of
administration on the therapeutic efficacy of penicillin. Am. J. Med. 9:280.
Errecalde, J. 1988. Bioequivalencia, Ensayos de Fármacos "in vitro" e "in
vivo". Boletín del Centro de Estudios para el Desarrollo de la Industria Químico-Farmacéutica Argentina. (29):5-10.
Errecalde, J. 1994a. Documento sobre productos genéricos. Boletín Técnico.
Pfizer, Sanidad Animal. Buenos Aires, Argentina. (176):1-6.
Errecalde, J. 1994b. El uso racional de los antimicrobianos en explotaciones
lecheras. Jornadas de Actualización en Lechería. Lincoln, Buenos Aires, Argentina.
Errecalde, J. 1995. Documento sobre productos genéricos (II Parte). Boletín
Técnico. Pfizer Sanidad Animal. Buenos Aires. Argentina. (180):1-5.
Errecalde, J. 1996. Antimicrobianos en leche: Su importancia en Salud
Pública. Boehringer Ingelheim S.A. Buenos Aires, Argentina.
Errecalde, J. 2000a. El control de puntos críticos en el tambo: ¿Una
alternativa viable en nuestro medio? Segundo Curso de Actualización Profesional Fisiopatología de la Lactancia y Calidad de Leche. Universidad Nacional de La Plata, INTA y CREA. Pp 99105.
Errecalde, J. 2000b. Uso racional de antibióticos en explotaciones lecheras.
Jornada de Antibióticos en Leche. Nueva Helvecia. Uruguay. Pp. 73-79.
Errecalde, J. 2001. Relation drug-host-ectoparasite. Workshop: Relationship
between pharmacokinetics and anthelmintic efficacy of endectocides. XVIII Congress WAAVP, Stressa, Italy. Pp 181-182.
Errecalde, J. 2003. La elección del medicamento de calidad. Libro de
resúmenes de las XIV Jornadas Ganaderas de Pergamino, Buenos Aires. Argentina. Pp. 72-76.
FAO/OIE/WHO. 2003. First Joint Expert Workshop on Non-human
Antimicrobial Usage and Antimicrobial Resistance: Scientific assessment. Background Document.
FAO/FIL. 2004. Guide to good dairy farming practice. Rome.
Galdston, I. 1943. Hasta llegar a las sulfamidas. Ed. Losada, Buenos Aires.
Gilson, et. al. 1993. Assessing prescribing practice: a tanzanian example.
International Journal of Health Planning and Management 8:37-58.
Goldstein, A., Aronow, L. & Kalman, S. 1974. Principles of Drug Action.
Second Ed. John Wiley and Sons Eds. Pp. 82-110.
Hall, R. 1997. Mobile gene cassettes and integrons: moving antibiotic genes
in Gram negative bacteria. Ciba Foundation Symposium. 207:192-205.
Hayward, C., Griffin, G. 1994. Antibiotic resistance: the current position
and the molecular mechanism involved. Br. J. Hosp. Med. 52, 473-478.
Uso de antimicrobianos en animales de consumo
Heinemann, J., Ankenbauer R. & Amabile-Cuevas C. 2000. Do
antibiotics maintain antibiotic resistance? Drug Discovery Today. 5(5):195-204.
Hui, L., Li, X. & Seng, X. 1997. Patterns and determinants of use of
antibiotics for acute respiratory tract infections in children in China. Paediatric Infectious Disease Journal. 16(6):560.
Holloway, K. 2000. ¿Quién contribuye al mal uso de los antimicrobianos?
Boletín de Medicamentos esenciales. Organización Mundial de la Salud. (28-29):9.
Jensen, B. 1998. The impact of feed additives on the microbial ecology of
the gut in young pigs. J. Anim. & Feed Sci. 7:45-64, Suppl. 1.
Kammer, R. 1982. Milestones in antimicrobial therapy. In: Morin, R.,
Gorman, M. Eds. Chemistry and Biology of Beta Lactam Antibiotics. Orlando, Florida: Academic Press.
Kato, I., Yokokura, T. & Nutai, M. 1985. Induction of tumoricidal
peritoneal exudates cells by administration of Lactobacillus casei. International Journal of Immuno-Pharmacology. 7:103-109.
Leggett, J., Fantin, B. & Ebert, S. 1989. Comparative antibiotic dose-effect
at several dosing intervals in murine pneumonia and tight infection models. J. Infect. Dis. 159:281-292.
Leggett, J., Ebert, S., Fantin, B. & Craig, W. 1991. Comparative dose-
effect relationship at several dosing intervals for beta-lactams, aminoglycoside and quinolone antibiotics against Gram negative bacilli in murine thigh infection and pneumonitis models. Scand. J. Infect. Dis. (Suppl. 74):179-184.
Lorian, V. 1980. Effects of subminimum inhibitory concentrations of
antibiotics on bacteria. In: Lorian Ed. Antibiotics in Laboratory Medicine. Baltimore: Williams and Wilkins. Pp. 342-408.
McDonald, L., Kuehaert, M., Trenoves, S. & Jarvis, W. 1997.
Vancomycin resistant enterococci outside the health care setting: prevalence sources and public health implications. Emerg. Infect.Dis. 3:311-317.
Mestorino, O. N. 2001. Control de residuos químicos en animales
productores de leche. Primeras Jornadas Técnicas de Ciencia y tecnología de Carnes y Alimentos. Montevideo, Uruguay.
O'Brien, T. 1997. The global epidemic nature of antimicrobial resistance
and the need to monitor and manage it locally. Clin. Infect. Dis. 24(suppl. 1):82:88.
Odenholt-Tornquist, I., Lowdin, E., Cars, O. 1992. Post-antibiotic sub-
MIC effects of vancomycin, roxithromycin, sparfloxacin and amikacina. Antimicrob. Agents Chemother. 36:1852-1858.
Prescott, J., Baggot, J. & Walter, R. 2002. Terapéutica Antimicrobiana en
Medicina Veterinaria. Tercera Edición. Intermédica. Buenos Aires.
Uso de antimicrobianos en animales de consumo
Quick, J., Rankin, J. & Laing, R. 1997. Managing drug supply. 2 De
Hartford CT: Kumarian Press.
Segal-Mauirer, S., Urban, C. & Rahal, J. 1996. Current perspectives in
multidrug-resistant bacteria.
Sheiner, L., Stanski, D., Vozeh, S., Niller, R., Ham, J. 1979. Simultaneous
modelling of pharmacokinetics and pharmacodynamics: Application to d-tubocurarine. Clinical Pharmacology and Therapeutics. 25(3):358-371.
Shahani, K., Friend, B. & Bailey, P. 1983. Antitumour activity of
fermented colostrums and milk. Journal of Food Protection, 46:385-386.
Sharpe, M., Hill, R. & Papage, S. 1973. Pathogenic lactobacilli. Journal of
Medical Microbiology. 6:281-286. Epidemiology and control. Infect. Dis. Clinics of North America. 10:939-957.
Soussy, C. (1998). Susceptibility testing of quinolones and links between in
vitro and in vivo resistance. Working paper 2. The use of quinolones in food animals and potential impact in human health. WHO Meeting 2-5 June 1998. Geneva, Switzerland.
Stobberingh, E. et al 1999. Enterococci with glycopeptide resistance in
turkeys, turkey farmers, turkey slaughterers and urban residents in the south of the Netherlands: Evidence of transmission of vancomycin resistance from animals to humans? Antimicrob. Agents. Chemother. 43, 2215-2221.
Sundin, G., Bender, C. 1996. Dissemination of the strA-strB streptomycin
resistante genes ammong commensal and pathogenic bacteria from humans, animals and plants. Mol. Ecol. 5, 133-143.
Tomke, S. & Elwinger, K. 1998. Growth promotants in feeding pigs and
poultry II: Mode of action of growth promotants. Annales de Zootechnie, 47:153-167.
Uppal, R. 1993. Antimicrobial use in primary health care. Journal of
Clinical Epidemiology. 46(7):671.
van der Waaji, D. 1971. Colonization resistance of the digestive tract in
conventional and antibiotic treated mice. J. Hydrol.69, 405-411.
Vogelman, B. & Craig W. 1986. Kinetics of antimicrobial activity. The
Journal of Pediatrics. 108(2):835-840.
Vogelman, B., Gudmundsson S., Leggett J., Turnidge J., Ebert S. &
Craig W. 1988. Correlating antimicrobial pharmacokinetic parameters
with therapeutic efficacy in an animal model. J. Infect. Dis. 158:831-837.
Wagner, J. C. 1968. Kinetics of pharmacological response. Journal of
Theoretical Biology. 20:173-201, 1968.
Wall, P. 1997. Epidemiological features of multidrug resistant Salmonella
typhimurium DT104 in England and Wales. The medical impact of the
Uso de antimicrobianos en animales de consumo
use of antimicrobial drugs in food animals. WHO meeting 13-17 October, Berlin, Germany.
Watts, J., Yancey, R. 1994. Proceedings. National Mastitis Council Annual
Meeting. Pp.14-19.
Weidermann, B. & Heisig, P. 1999. Bakterielle resistanz gegenuber
chinolonen. Chemotherapie Journal 8, 99-107.
Woodnut, G. & Berry, V. 1999. Two pharmacodynamic models for
assessing the efficacy of amoxicillin-clavulanate against experimental respiratory tract infections caused by strains of Streptococcus pneumoniae. Antimicrob. Agents Chemother. 43:29-34.
Wooldridge, M. 1999. Qualitative risk assessment for antibiotic resistance.
Report for EMEA. Annex IV. Case study: Salmonella typhimurium and the quinolone/fluoroquinolone class of antibiotics. pp. 38-39.
Ziv, G. 1995. Treatment of mastitis: An overview of progress during the last
ten years. The 3 International Mastitis Seminar. Session V. May 28-June 1, Tel Aviv, Israel. pp. 312.
El uso de antimicrobianos en animales de consumo es un asunto de gran interés para los diversos agentes interesados en los resultados y consecuencias de su aplicación: veterinarios, médicos, microbiólogos, autoridades sanitarias y de registro, industrias alimentarias y farmacéuticas, consumidores y la población en general. La utilización de antimicrobianos en animales es una causa de riesgos reales de generación de resistencias bacterianas y de eventual transmisión de organismos zoonóticos resistentes –o de determinantes genéticos de resistencia– al hombre. La importancia de este asunto ha conducido a tres organizaciones internacionales (la FAO, la Oficina Internacional de Epizootias [OIE] y la Organización Mundial de la Salud [OMS]) a realizar recientemente dos talleres conjuntos con el objeto de formular recomendaciones para los países miembros. A la luz de los nuevos conocimientos sobre antibioticoterapia, resulta evidente la necesidad de difundir información sobre el uso de antimicrobianos, los nuevos antibióticos, los criterios para determinar susceptibilidad o resistencia a un grupo específico de medicamentos, los mecanismos y tipos de resistencias bacterianas, la farmacodinamia de los diversos agentes y la relación de ésta con las concentraciones del antimicrobiano in vitro e in vivo. En la presente publicación, se analizan de forma integral los conocimientos disponibles sobre el uso racional de los antimicrobianos.
ISBN 92-5-305150-7
Source: http://www.snatural.com.br/PDF_arquivos/Biocida-Animais.pdf
A. Elmanama et al., J. Al-Aqsa Unv., 10 (S.E.) 2006 Contribution of Hospital Wastewater to the Spread of Antibiotic Resistance in Comparison to Non-Health Institution Dr. Abdelraouf A. Elmanama * Dr. Abboud Y. ElKichaoui ** Miss. Mai Mohsin ∗∗* ﺭﻴﻭـﻁﺘ ﻩﺎـﺠﺘﺍ ﻲﻓ ﺭﺍﺩﺤﻨﻼﻟ ﺔﻓﺎﻀ ﻹﺎﺒ ﺔﻴﻭﻴﺤﻟﺍ ﺕﺍﺩﺎﻀﻤﻠﻟ ﺔﻤﻭﺎﻘﻤﻟﺍ ﺔﻠﻜﺸﻤﻟ ﺔﻴﻤﺎﻌﻟﺍ ﺓﺩﺎﻴﺯﻟﺍ ﺎﻴﺭﻴﺘﻜﺒﻟﺍ ﺔﻤﻭﺎﻘﻤ ﺭﻭﺼ ﺔﺴﺍﺭﺩﻟ ﺙﺤﺒﻟﺍ ﺍﺫﻫ ﻡﻤﺼ .
Horizonten Wie Pharmaforscher Medikamente entwickeln Eine Sonderpublikation in Zusammenarbeit mit der Boehringer Ingelheim GmbH Vom Elfenbeinturm zum Forschungsbiotop 02 _ Vom Elfenbeinturm zum Früher konnte es sehr lange dauern, bis neue wissenschaftliche Erkenntnisse in die Pharmaforschung einflossen. Der Grund dafür waren starke











