Viagra gibt es mittlerweile nicht nur als Original, sondern auch in Form von Generika. Diese enthalten denselben Wirkstoff Sildenafil. Patienten suchen deshalb nach viagra generika schweiz, um ein günstigeres Präparat zu finden. Unterschiede bestehen oft nur in Verpackung und Preis.
Fcc19 mise en page
SOMMAIRE
G.MENTHA (Genève)
F.-R. PRUVOT (Lille)
J.-Y. MABRUT (Lyon)
Kyste biliaire simple et formes compliquées
P. PESSAUX (Strasbourg)
Polykystose hépatique
J. HARDWIGSEN (Marseille)
Cystadénome biliaire, cystadénocarcinome et autres tumeurs
malignes kystiques
O. SCATTON (Paris)
Lésions infectieuses parasitaires du foie
G. MANTION (Besançon)
Mercredi 5 octobre 2011
FCC 19 - Prise en charge des lésions kystiques du foie
KYSTES HÉPATIQUES DIAGNOSTIC ET ORIENTATIONS THÉRAPEUTIQUES
Patrick PESSAUX
Pôle des Pathologies Digestives, Hépatique et de la Transplantation
Hôpitaux Universitaires de Strasbourg
67000 STRASBOURG
Tél: 02 41 35 36 18
Email:
[email protected]
Kystes Hépatiques :
Les kystes simples hépa:ques sont fréquents avec une prévalence évaluée par échographie de 2.5 à 3.8 %.
Ce=e prévalence augmente avec l'âge et le sex-ra:o est de 3 femmes pour 2 hommes. Dans la majorité des cas,
les kystes sont asymptoma:ques. Seul les volumineux kystes ou les kystes compliqués peuvent s'exprimer
cliniquement par des douleurs abdominales ou par un syndrome de masse épigastrique ou de l'hypochondre
droit. Le diagnos:c est affirmé par l'échographie dont les critères sont : une image ronde ou ovalaire avec un
contenu anéchogène et un contour net, sans paroi, et avec un renforcement postérieure. Il n'existe jamais de
cloisons, d'images endokys:ques ou de calcifica:ons. La tomodensitométrie ou l'IRM n'apporte pas de
renseignements diagnos:ques ajoutés. Les complica:ons sont très rare et ne concernent en pra:que que les
volumineux kystes de 8-10 cm. Il s'agit essen:ellement d'hémorragie intrakys:que, de compression d'organe de
voisinage, de rupture, et d'infec:on. Les kystes hépa:ques asymptoma:ques ne nécessitent ni traitement, ni
surveillance. Seuls les kystes symptoma:ques, compliqués, ou posant un doute diagnos:que, sont des
indica:ons thérapeu:ques. La simple ponc:on évacuatrice ne peut être envisager que comme un test
thérapeu:que en soulageant temporairement les douleurs ou la compression, mais la récidive est quasi
constante. L'alcoolisa:on percutanée ob:ent un taux d'échec très faible. Elle a pour but de tarir la sécré:on du
kyste par destruc:on de l'épithélium de revêtement. La procédure commence par une évacua:on du kyste et
une kystographie pour éliminer une communica:on avec les voies biliaires qui est une contre indica:on à la
technique. Puis de l'alcool à 95° est injectée (25% du volume aspiré) et laissé en place environ 20 minutes avant
d'être complètement ré aspirée. Le traitement chirurgical est proposé au kyste récidivant, au kyste compliqué,
ou en cas de doute diagnos:que. Le principe de l'interven:on est une résec:on du dôme saillant, réalisé sous
laparotomie ou laparoscopie. La kystectomie totale ou la résec:on hépa:que n'est indiquée qu'en cas de doute
diagnos:que avec un cystadénocarcinome.
FCC 19 - Prise en charge des lésions kystiques du foie
Arbre décisionnel : Orientation thérapeutique devant un kys te hépatique.
contenu anéchogène
Images endokystiques
renforcement postérieur
Contenu hétérogène
DIAGNOSTIC DIFFERENTIEL OU
Kyste hémorragique
Kyste endométriosique
Ponction biopsie.
Pas de surveillance.
FCC 19 - Prise en charge des lésions kystiques du foie
PRISE EN CHARGE DES LESIONS KYSTIQUES DU FOIE : LA POLYKYSTOSE
HEPATIQUE.
Pr Jean HARDWIGSEN
Service de chirurgie générale et transplantation hépatique,
CHU La Conception, 147 Bd Baille,
Email :
[email protected]
1. Généralités
La polykystose hépatique (PKH) est une affection autosomique dominante rare dont la prévalence est
inférieure à 0,1 %.1 Caractérisée par le développement au cours de la vie de kystes hépatiques elle est
fréquemment associée à la polykystose rénale. Dans plus de 80% des cas la PKH est asymptomatique, et ne
requiert aucun traitement.2
Le diagnostic de PKH est rarement porté avant l'âge adulte. Plus fréquentes (90% des cas) et plus évolutives
chez la femme, les formes symptomatiques sont essentiellement dues au développement rapide de la taille des
kystes. Résultant en une hépatomégalie massive responsable de la compression des structures anatomiques
adjacentes (tube digestif, veine cave inférieure et diaphragme), ces formes cliniques affectent en premier lieu
la qualité de vie et l'état général des patients.3 Les autres complications hépatiques (hémorragies et infections
intra kystiques, ascite, hypertension portale) sont rares voire exceptionnelles (insuffisance hépatique ou
dégénérescence).4 Il n'existe pas de traitement médical efficace.5 Le traitement chirurgical, ayant pour but de
réduire la taille des kystes ou le volume hépatique, fait appel à différentes techniques: l'aspiration et la sclérose
des kystes, la fenestration kystique et la résection hépatique, plus rarement la transplantation hépatique. Le
choix thérapeutique est basé sur la taille, le nombre et la distribution des kystes mais aussi sur l'efficacité à
long terme des procédures.3
2. Pathogénie et évolutivité
La PKH est une anomalie héréditaire de l'épithélium biliaire causée par un défaut génétique des protéines
associées aux organelles intracellulaires. Elle se caractérise par la formation et la croissance progressive de
kystes répartis dans le parenchyme hépatique.6 Le PKH associée à une atteinte rénale est la forme la plus
fréquente (plus de 80% des patients atteint de PK rénale ont des kystes hépatiques7). La polykystose hépato
rénale (PKHR) est causée par la mutation d'un des deux gènes (PKD1 ou PKD2) codant pour des protéines
transmembranaires, respectivement : la polycystine 1 et la polycystine 2. Les polycystines régulent le
développement tubulaire et vasculaire des reins et d'autres organes (foie, cerveau, cœur, pancréas)7. Outre le
rein et le foie, des kystes peuvent être retrouvés dans le pancréas, l'arachnoïde, les vésicules séminales,
FCC 19 - Prise en charge des lésions kystiques du foie
associés à d'autres anomalies : anévrismes intracrâniens, prolapsus de la valve mitrale, dilatation de l'anneau
La PKH sans atteinte rénale est plus rare et résulte, dans un tiers des cas,8 de la mutation de 2 autres gènes :
PRKCSH ou SEC63 codant pour des enzymes de régulation du système du réticulum endoplasmique.9
Cependant l'aspect histopathologique des kystes est identique que l'atteinte hépatique soit isolée ou associée
à une polykystose rénale et quel que soit le gène impliqué dans l'anomalie.10 Les kystes hépatiques se forment
à partir de microhamartomes péribiliaires (complexe de von Meyemburg) provenant de la prolifération
excessive et de la dilatation des ductules biliaires et des glandes péri biliaires.8 L'expansion kystique est
multifactorielle associant une prolifération de l'épithélium bordant les kystes, une sécrétion intra luminale, un
remodelage de la matrice extracellulaire et une néovascularisation.10
Les kystes du foie sont rares dans l'enfance et vont apparaître et croitre avec l'âge.8 Chez la femme la
prévalence et la taille des kystes sont supérieures à celles des hommes8. Des grossesses répétées ou un apport
exogène en œstrogènes sont considérés comme des facteurs de risques de développement rapide des kystes
hépatiques.11,12 Dans ce contexte, les hépatomégalies massives surviennent rarement avant 40 ans.7
3. Définition et présentation clinique et examens paracliniques
Le diagnostic est simple pour un patient présentant de multiples kystes au rein et au foie et des antécédents
familiaux.4 En revanche, après la découverte de quelques kystes hépatiques isolés et asymptomatique chez un
adulte jeune, le diagnostic de PKH est difficile à porter.4 Le diagnostic génétique est rarement mis en œuvre, un
suivi est conseillé.4 Si elle se définit par la présence de plus de 5 kystes intra hépatiques4, la forme habituelle
associe une multitude de kystes3 (n>20) de taille et de distribution variables.
Les formes symptomatiques, les plus rares, sont dues à l'effet de masse ou à des complications kystiques.8 Les
symptômes liés à l'augmentation du volume du foie résultent de la compression des structures adjacentes : les
viscères intra abdominaux (satiété précoce, douleurs abdominales ou douleurs mécaniques dorsales, sensation
de plénitude abdominale, asthénie, RGO et malnutrition), le diaphragme (dyspnée), les vaisseaux (œdème des
membres inférieur, ascite, syndrome de Budd-Chiari). Les complications intra kystiques sont révélées par des
symptômes d'apparition rapides voire aigue (hémorragie, infection, exceptionnellement rupture ou torsion).
L'infection de kyste hépatique a été incriminée dans plus de 10% de décès chez des patients avec des formes
évoluées de PKHR.13
En dépit de l'importance de la taille et du nombre des kystes les fonctions hépatiques de synthèse sont
conservées. Les compressions biliaires rendent compte plus fréquemment de l'élévation de la GT et des
phosphatases alcalines, rarement d'un ictère.3 Les examens morphologiques préopératoires, TDM et IRM,
doivent préciser la taille et la distribution des kystes, leur contenu, les compressions veineuses éventuelles (VCI
et veines hépatiques), les volumes et les segments de parenchymes épargnés par les kystes. Les classifications
pré thérapeutiques reposent sur ces données morphologiques.
FCC 19 - Prise en charge des lésions kystiques du foie
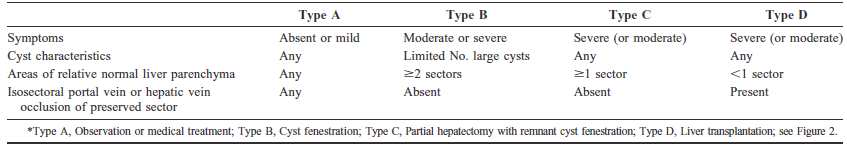
4. Classifications
En l'absence de critères standardisés pour la prise en charge thérapeutique, plusieurs classifications ont été
proposées. La plus communément utilisée est celle de Gigot et al.14, elle prend en compte le type, le nombre et
la répartition des kystes. Plus récemment Schnelldorfer et al.3, l'ont complétée par des données cliniques (Fig. 1
5. Traitements
5. a. Traitement médical
Il n'existe pas de traitement médical efficace de la PKH.5 Les analogues de la somatostatine5 ou plus
récemment les inhibiteurs mTOR15 n'ont pas prouvé leur efficacité sur la croissance des kystes. Si l'influence
défavorable des traitements œstrogéniques de substitution ou des grossesses a été rapportée sur l'évolution
des seuls kystes hépatiques, le bénéfice du blocage hormonal n'est pas avéré.11 Dans les formes graves de PKH,
l'éviction des œstrogènes et de substance favorisant l'accumulation de l'AMPc (i.e. la caféine) est
5. b. Techniques instrumentales et chirurgicales
Le choix des autres traitements : aspiration associée à une sclérose (alcool), fenestrations kystiques, résections
hépatiques et transplantation hépatique, est actuellement basé sur les classifications suscitées. Les ponctions
évacuatrices isolées des kystes non compliqués, soulagent les patients mais exposent à une récidive
inéluctable. 13 Le traitement optimal des kystes hépatiques infectés repose sur un drainage percutané associé à
une antibiothérapie systémique.16
FCC 19 - Prise en charge des lésions kystiques du foie
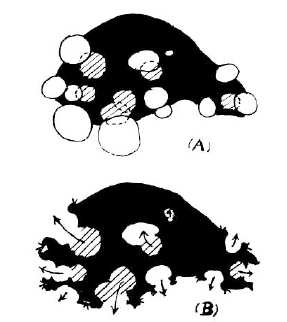
- Fenestration
Décrite par Lin et Al.17 en 1968, la technique consiste, en réséquant une partie de leur paroi, à faire
communiquer les kystes, depuis la profondeur vers la superficie du foie, en assurant un drainage interne vers la
cavité péritonéale. (Fig. 2 B). Initialement décrite par laparotomie, la fenestration a été proposée par
cœlioscopie à partir des années 90. 18,19 Le taux de conversion et de récidive pour les types B ou C de
Schnelldorfer étant important, la fenestration par cœlioscopie est devenue le traitement des gros kystes
localisés des segments antérieurs du foie.3,20
En effet, les larges fenestrations des segments postérieurs doivent être évitée en raison du risque rapporté de
syndromes de Budd-Chiari mortels, par bascule du foie.13
En fin de procédure, la résorption des sécrétions kystiques par le péritoine impose souvent un drainage
prolongé afin de contrôler l'ascite postopératoire.18 Certains auteurs recommandent dans cette situation, la
destruction de l'épithélium des cavités résiduelles par électrocoagulation ou au laser argon. 21 Les fenestrations
se caractérisent par une amélioration de courte durée et une récidive fréquente. 3,14,19,22
- Résection hépatique
La procédure de choix associe une résection hépatique à la fenestration des kystes résiduels les plus
volumineux. Décrite par Armitage en 198423, elle nécessite des hépatectomies majeures dans presque tous les
cas et ne sont envisagées que si les examens préopératoires doivent permettre de visualiser au moins 2
segments hépatiques contigus sans kyste.3,13
Les modifications parfois majeures de l'anatomie intra hépatique, sont une source potentielle de complications
périopératoires (plaies biliaires et ischémie hépatiques) et peuvent rendre imprécises les limites de résections.
3,13. En raison de la rigidité du parenchyme et du volume du foie, les accès au pédicule hépatique et à la veine
cave sont parfois difficiles. Ces interventions sont complexes, longues et hémorragiques (80% des patients
transfusés dans une série récente3). Dans des situations extrêmes, des transplantations hépatiques de
sauvetage ont été nécessaires. 3 Bien que les résections hépatiques soient grevées dans la PKH, d'une
importante morbidité (>50%), 3,13,20 la survie à 10 ans est de 90 % avec une résolution durable des symptômes
sans insuffisance hépatique.3.
FCC 19 - Prise en charge des lésions kystiques du foie
- Place de la transplantation hépatique
Elle est réservée en derniers recours aux formes massives, et diffuses d'hépatomégalie à petits kystes, éligibles
pour aucun autre traitement. Certaines indications, rares, sont facilement identifiées notamment en cas
d'association à une hypertension portale symptomatique, un syndrome de Budd-Chiari. Dans la grande
majorité des cas, c'est l'importance du volume hépatique et ses répercussions nutritionnelles, sociales et
professionnelles qui indiquent la greffe.24 La PK Rénale est la première cause de dialyse en France et représente
une indication fréquente de transplantation rénale. L'indication d'une double greffe (foie-rein) ne doit être
envisagée qu'au stade terminal de l'insuffisance rénale.24 L'absence d'insuffisance hépatique dans la PKH rend
l'accès à la transplantation limité dans des systèmes de répartition des greffons hépatiques, basés en très
grande partie comme en France, sur le score MELD. Une priorisation après avis d'expert permet un accès plus
rapide aux greffons.
5. c. Indications thérapeutiques
Les PKH dont les symptômes affectent la qualité de vie ou l'état général des patients, représente la plus
fréquente indication thérapeutique. 3,5,8. Les autres indications regroupent les PKH avec obstacle veineux,
ascite réfractaire, kystes infectés réfractaires aux traitements percutanés…
Le choix entre résection hépatique et fenestration de kystes résiduels et transplantation hépatique est souvent
délicat. La première option expose à un risque de récidive à partir de kystes restants la deuxième assure la
radicalité au prix d'une immunosuppression à vie dans un contexte de pénurie d'organes.
6. Conclusions
- Le diagnostic des PKHR est en général facile alors que celui de PKH est plus difficile au début.
- Si la PKR représente une des premières causes d'insuffisance rénale terminale, la PKH n'entraine
qu'exceptionnellement une insuffisance hépatique.
- Seules les formes symptomatiques de PKH doivent être traitées.
- La fenestration par cœlioscopie est retenue pour les patients présentant de gros kystes hépatiques, localisés,
situés de préférences dans les secteurs antérieurs du foie.
- Une résection hépatique avec fenestration complémentaire de kystes est le traitement des PKH avec un
secteur hépatique épargné.
- Dans les formes diffuses sans parenchyme pouvant être épargné, la transplantation hépatique est retenue. La
possibilité d'une transplantation rénale ne doit pas influer le choix thérapeutique pour le foie.
Karhunen PJ, Tenhu M. Adult polycystic liver and kidney diseases are separate entities. Clin Genet
FCC 19 - Prise en charge des lésions kystiques du foie
Bistritz L, Tamboli C, Bigam D, Bain VG. Polycystic liver disease: experience at a teaching hospital. Am
J Gastroenterol 2005;100:2212-7.
Schnelldorfer T, Torres VE, Zakaria S, Rosen CB, Nagorney DM. Polycystic liver disease: a critical
appraisal of hepatic resection, cyst fenestration, and liver transplantation. Ann Surg 2009;250:112-8.
Arnold HL, Harrison SA. New advances in evaluation and management of patients with polycystic
liver disease. Am J Gastroenterol 2005;100:2569-82.
Everson GT, Taylor MR, Doctor RB. Polycystic disease of the liver. Hepatology 2004;40:774-82.
Strazzabosco M, Somlo S. Polycystic liver diseases: congenital disorders of cholangiocyte signaling.
Gastroenterology 2011;140:1855-9 e1.
Grantham JJ. Clinical practice. Autosomal dominant polycystic kidney disease. N Engl J Med
2008;359:1477-85.
Torres VE, Harris PC, Pirson Y. Autosomal dominant polycystic kidney disease. Lancet 2007;369:1287-
Fedeles SV, Tian X, Gallagher AR, et al. A genetic interaction network of five genes for human
polycystic kidney and liver diseases defines polycystin-1 as the central determinant of cyst
formation. Nat Genet 2011.
Qian Q. Isolated polycystic liver disease. Adv Chronic Kidney Dis 2010;17:181-9.
Sherstha R, McKinley C, Russ P, et al. Postmenopausal estrogen therapy selectively stimulates
hepatic enlargement in women with autosomal dominant polycystic kidney disease. Hepatology
Gabow PA, Johnson AM, Kaehny WD, Manco-Johnson ML, Duley IT, Everson GT. Risk factors for the
development of hepatic cysts in autosomal dominant polycystic kidney disease. Hepatology
Soravia C, Mentha G, Giostra E, Morel P, Rohner A. Surgery for adult polycystic liver disease. Surgery
Gigot JF, Jadoul P, Que F, et al. Adult polycystic liver disease: is fenestration the most adequate
operation for long-term management? Ann Surg 1997;225:286-94.
Renken C, Fischer DC, Kundt G, Gretz N, Haffner D. Inhibition of mTOR with sirolimus does not
attenuate progression of liver and kidney disease in PCK rats. Nephrol Dial Transplant 2011;26:92-
Telenti A, Torres VE, Gross JB, Jr., Van Scoy RE, Brown ML, Hattery RR. Hepatic cyst infection in
autosomal dominant polycystic kidney disease. Mayo Clin Proc 1990;65:933-42.
Lin TY, Chen CC, Wang SM. Treatment of non-parasitic cystic disease of the liver: a new approach to
therapy with polycystic liver. Ann Surg 1968;168:921-7.
Farges O, Bismuth H. Fenestration in the management of polycystic liver disease. World J Surg
Kabbej M, Sauvanet A, Chauveau D, Farges O, Belghiti J. Laparoscopic fenestration in polycystic liver
disease. Br J Surg 1996;83:1697-701.
FCC 19 - Prise en charge des lésions kystiques du foie
Li TJ, Zhang HB, Lu JH, Zhao J, Yang N, Yang GS. Treatment of polycystic liver disease with resection-
fenestration and a new classification. World J Gastroenterol 2008;14:5066-72.
Que F, Nagorney DM, Gross JB, Jr., Torres VE. Liver resection and cyst fenestration in the treatment
of severe polycystic liver disease. Gastroenterology 1995;108:487-94.
Katkhouda N, Hurwitz M, Gugenheim J, et al. Laparoscopic management of benign solid and cystic
lesions of the liver. Ann Surg 1999;229:460-6.
Armitage NC, Blumgart LH. Partial resection and fenestration in the treatment of polycystic liver
disease. Br J Surg 1984;71:242-4.
Hardwigsen J, Gay A, Belghiti J, et al. Liver transplantation for polycystic liver disease. Results of a
French multicentic 56 case-series. In: 57th Annual meeting of AASLD. Boston: Hepatology;
FCC 19 - Prise en charge des lésions kystiques du foie
LESIONS KYSTIQUES HEPATIQUES
CYSTADENOME CYSTADENOCARCINOME ET AUTRES TUMEURS MALIGNES
KYSTIQUES
Olivier Scatton
Saint Antoine Paris
Email : [email protected]
Le cadre nosologique de cet exposé se limite aux lésions kystiques non parasitaires, et exclue également les
dilatations kystiques des macro voies biliaires (Maladie de Caroli et kyste du cholédoque de type IV) et la
papillomatose biliaire à forme kystique. Il ne s'agit pas non plus de décrire le kyste biliaire simple et ses
éventuelles complications hémorragiques voire plus exceptionnellement infectieuses. La démarche
diagnostique doit essentiellement permettre de suspecter un cystadénome biliaire et les lésions malignes
(cystadénocarcinome et métastase). Savoir distinguer ces lésions permet de ne pas méconnaitre une indication
opératoire et de définir l'intervention la plus adaptée. Il s'agit le plus souvent d'une résection la plus
oncologique possible et qui doit anticiper la principale complication liée à ce type de pathologie ; la séquence
fistule-sténose biliaire.
Le cadre nosologique de cette pathologie comprend donc le diagnostic et traitement :
• Cystadénome et cystadénocarcinome biliaire • Métastase kystique (endocrine+++)
Exceptionnellement
• Kyste à revêtement cilié • Sarcome
La démarche diagnostique doit donc permettre de suspecter une lésion maligne ou à potentiel dégénératif à
l'aide de l'histoire clinique (Ictère-masse, altération de l'état général, fièvre), d'un bilan biologique minimal et
d'une imagerie exhaustive.
Cystadénome et cystadénocarcinome
Il s'agit d'une pathologie de la femme après 40 ans (80%). Les cystadénomes biliaires sont 100 à 1000 fois plus
rares que les kystes biliaires simples. Le syndrome de masse et l'ictère sont deux signes cliniques qui doivent
alerter et faire suspecter cette pathologie en première intention. Toute symptomatologie de ce type doit de
toute manière remettre en cause le diagnostic de kyste biliaire simple.
Les symptômes sont souvent liés soit à l'effet de masse de ces tumeurs volontiers volumineuses soit à la
fistulisation et à la migration intrabiliaire de matériel mucineux contenu dans ces kystes. L'épithélium de ces
lésions est cuboïde, de type biliaire identique à celui des kystes biliaires simples mais repose sur un membrane
FCC 19 - Prise en charge des lésions kystiques du foie
basale. Contrairement au kyste simple, il existe des formations polypoides secrétantes qui se traduisent sur le
plan radiologique par des expansions intrakystiques polypoides, des nodules muraux et un stroma ovarien. Il
existe également des cloisons qui le distinguent du kyste simple. Il est intéressant de noter qu'il existe un
marquage pour le CA19.9 en immunohistochimie. Cependant, ce marquage existe également dans certains
kystes simples. Ainsi, le dosage du CA19.9 dans le kyste n'a pas de valeur discriminante. Le dosage sérique est
intéressant mais n'est pas non plus déterminant. Il doit être réalisé avant toute ponction de kyste pour éviter le
passage sanguin de ce dernier même en cas de kyste biliaire simple. L'ACE peut être augmenté en cas de
cystadénocarcinome. Il est très difficile de distinguer cliniquement et morphologiquement un cystadénome
d'un cystadénocarcinome. La dégénérescence maligne n'est pas toujours homogène et peut intervenir sur une
partie limitée d'un cystadénome. Ainsi, la résection doit être complète et de type carcinologique. Le traitement
chirurgical doit également intégrer soit la distension de la convergence biliaire soit la fistule avec le plus
souvent la convergence biliaire supérieure. Toute résection doit anticiper la complication biliaire et ses
éventuelles conséquences. Une imagerie biliaire au mieux non invasive par Bili IRM est donc indispensable.
Certaines maneuvres endoscopiques préventives (non validées pour le moment) peuvent se discuter
(intubation préventive d'un secteur du futur foie restant en particulier dans les résections antérieures).
Néanmoins, la compression ne permet pas toujours de drainer par voie endoscopique le secteur postérieur. Le
diagnostic de cystadénome voire de cystadénocarcinome repose sur l'analyse de l'imagerie. L'échographie
recherche des signes qui éliminent le kyste biliaire simple : cloisons, végétations, forme polylobée à contours
irréguliers. En TDM, la paroi du volumineux kyste apparaît épaisse, il existe des cloisons, des nodules muraux
font suspecter la nature maligne ainsi que des calcifications. L'IRM est un très bon examen car il permet à la
fois la caractérisation et le diagnostic de complications biliaires associées (compression, fistule).
Le cystadénocarcinome peut donner des métastases intra hépatiques et à distance. Le dosage de l'ACE n'est
pas discriminant entre cystadénome et cystadénocarcinome.
Le traitement repose sur la résection complète même lors d'une découverte fortuite. Il existe un risque de
récidive après résection incomplète et la dégénérescence n'est pas obligatoirement uniforme.
La métastase kystique
Toute lésion kystique atypique doit faire évoquer une métastase kystique. La principale tumeur est endocrine
et peut être non secrétante et asymptomatique. Les autres types de métastases surviennent dans un contexte
plus évocateur ; mélanome, sarcome, et cancer du sein, cancer du canal anal et métastase de
cystadénocarcinome ovarien. La résection se discute en fonction de l'étiologie et de l'évolution tumorale. Elle
est carcinologique.
Kyste à revêtement cilié
C'est une lésion rare survenant indifféremment chez la femme ou l'homme vers l'âge de 50 ans. Il peut être
assimilé à un kyste bronchogénique, est localisé dans le foie gauche le plus souvent (origine embryonnaire) et
est constitué de 4 couches dont une couche interne de type épithélium bronchique et une capsule externe
fibreuse. Il s'agit d'une lésion le plus souvent asymptomatique. L'imagerie montre une lésion du foie gauche
FCC 19 - Prise en charge des lésions kystiques du foie
sous capsulaire et d'environ 3 à 4 cm de diamètre. D'exceptionnels cas de forme maligne ont été rapportés
pour des lésions supérieures à 10 cm. La résection chirurgicale de ce type de lésion est la règle et permet
souvent un diagnostic rétrospectif.
Sarcome embryonnaire du foie
Il faut évoquer ce diagnostic chez un sujet jeune (adolescence en particulier). Il s'agit d'une tumeur
mésenchymateuse du foie, de haut grade de malignité. Elle mesure environ 10 à 20 cm de diamètre et est
diagnostiquée dans un contexte d'altération de l'état général, de douleur et de fièvre. La lésion est souvent
incomplètement kystique. Le diagnostic est difficile (confusion avec un abcès parfois en raison de l'âge jeune et
de la fièvre) et le pronostic inférieur à 30% après résection. La résection complète est la règle. Les traitements
complémentaires ne sont pas codifiés (chimiothérapie).
Démarche diagnostique
Le syndrome de masse avec altération de l'état général, perte de poids associé ou non à un ictère doit faire
évoquer le diagnostic de cystadénome biliaire, de cystanocarcinome ou de métastase kystique. Il convient
d'éliminer un kyste hydatique (contexte et sérologie). Les examens à demander au minimum sont :
• NFS-plaquettes, bilan hépatique complet • Sérologie hydatidose • CA19. 9, ACE, Chromogranine A
• Echographie • TDM thoraco-abdomino-pelvien (rapport vasculaire) • IRM hépatique avec séquence biliaire (+++)
Ponction si doute persiste avec une lésion de kyste biliaire compliqué ou suspicion de métastase.
Dosage ACE, CA19.9 et cytologie +++
Traitement
Le traitement des lésions kystiques n'est jamais une fenestration et l'énucléation doit être évitée. Il est
préférable de réaliser des résections avec des marges parenchymateuses surtout lorsque la lésion est
volumineuse, donc suspecte de malignité. La laparoscopie n'est pas contre indiquée en particulier pour les
lésions situées dans le foie gauche. La résection de lésions localisées à droite est souvent plus difficile
essentiellement en rapport avec des complications biliaires associées (compression, ischémie de plaque hilaire
et fistule) et la laparotomie est plus logique. Le drainage biliaire et externe doit être utilisé largement car ces
lésions (surtout les cystadénocarcinomes et les cystadénomes) sont associées à des complications biliaires
postopératoires.
FCC 19 - Prise en charge des lésions kystiques du foie
1. O. Farges and V.Vilgrain. Nonparasitic Cystic Diseases of the liver and intrahepatic biliary tree. Surgery
of the Liver, Biliary tract and Pancreas. LH BLumgart. Fourth Edition. Volume 2. Chap 64. p1005. 2007
2. JF Cadranel, JP Benhamou. Cystadénome du foie. Hépato-gastro, 1998, 5 : 109-114 .
3. Lewin M, Mourra N, Honingman I et al. Assessment of MRI and MRCP in diagnosis of biliary
cystadenoma and cystadenocarcinoma. Eur Radiol 2006, 16 : 407-413.
4. Mortelé KJ, Ros PR. Cystic focal liver lesions in the adult : differential CT and MR Imaging features.
Radiographics 2001. 21 : 895-910.
5. Chatelain D, Chailley-Heu B, Terris B et al. The ciliated hepatic foregut cyst, an unusual bronchiolar
malformation : a histological, histochemical and immunohistochemicalstudy of 7 cases. Hum Pathol.
2000, 31 : 241-246.
6. Stocker JT, Ishak KG. Undifferenciated sarcoma of the liver ; report of 31 cases. Cancer 1978, 42 : 336-
7. Almogy G, Lieberman S, Gips M et al. Clinical outcomes of surgical résections for primary liver sarcoma
in adults : results from a single centre. Eur J Surg Oncol 2004, 30 : 421-427.
FCC 19 - Prise en charge des lésions kystiques du foie
PRISE EN CHARGE DES LESIONS KYSTIQUES PARASITAIRES DU FOIE
G. MANTION,
S. BRESSON-HADNI,
DA VUITTON (CCOMS Besançon)
Centre Hospitalier Universitaire
C.H.U. Jean Minjoz
25030 BESANCON CEDEX
Tél: 03 81 66 82 43
Email: [email protected]
Les lésions kystiques parasitaires du foie constituent une pathologie relativement rare en France, mais doivent
être reconnues car leur traitement est très spécifique. Elles sont considérées commes « neglected diseases »
par l'OMS et font l'objet de réunions internationales de consensus pour essayer de codifier leur prise en charge
Les principales pathologies rencontrées sont :
Le kyste hydatique ou échinococcose kystique lié à echinococcus granulosus qui présente une large
distribution sur tous les continents mais pas ou peu de cas autonomes en France où il s'agit d'une
pathologie importée.
L'échinococcose alvéolaire ou multikystique liée à echinococcus multilocularis surtout répandue dans
l'hémisphère nord et en particulier en France où elle reste malheureusement assez méconnue.
L'échinococcose tropicale liée à echinococcus voegeli et oligarthus rencontrée essentiellement en
Amazonie ne sera pas développée ici.
Le kyste hydatique correspond à une pathologie bénigne au moins au départ qui se développe en
refoulant les structures vasculaires et biliaires.
a. Les critères diagnostics sont au nombre de 4 :
l'imagerie qui va montrer des images plus ou moins typiques en particulier en échographie qui
est le plus souvent utilisée dans les pays d'endémie. La classification de Gharbi modifiée par
l'OMS (2) permet d'identifier 6 types de lésions (voir tableau),
la sérologie avec les tests à haute sensibilité confirmés par un test à haute spécificité (10 % de
faux négatifs néanmoins),
la visualisation directe du protoscolex ou des crochets dans le liquide du kyste,
FCC 19 - Prise en charge des lésions kystiques du foie
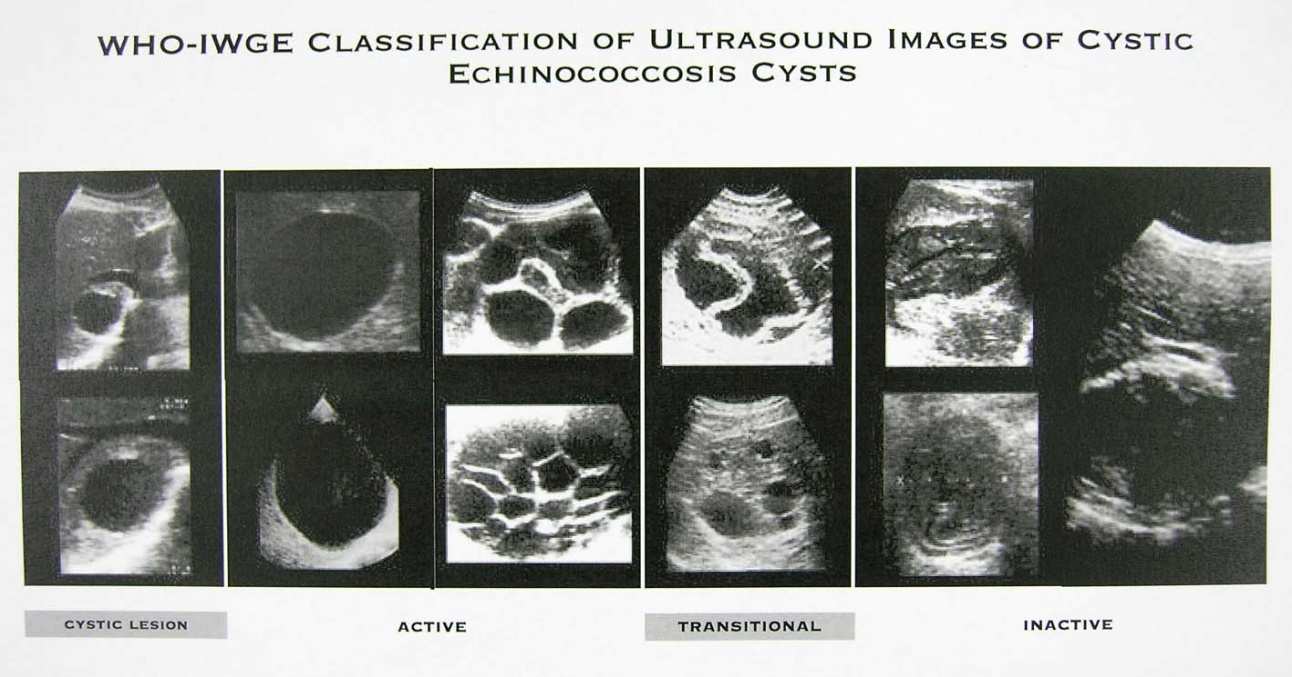
l'aspect macroscopique typique du kyste sur les pièces opératoires (3,4).
Le traitement chirurgical est indiqué pour les gros kystes CE2-CE3b, les kystes superficiels (risque de rupture)
les kystes infectés, les kystes communicants avec les voies biliaires, les kystes comprimant les organes vitaux
adjacents. La chirurgie n'est pas indiquée en cas de contre-indication générale, de kystes inactifs (CE4, CE5), de
petits kystes. L'objectif du traitement est de supprimer le matériel parasitaire sans mettre en danger la vie du
patient car il s'agit d'une maladie bénigne. La périkystectomie totale fermée ou ouverte correspond au
traitement radical de cette lésion selon les recommandations de l'OMS. La difficulté est de trouver le bon plan
de clivage et d'éviter les lésions des gros vaisseaux et des voies biliaires. La périkystectomie partielle
abandonne souvent de necessité la partie centrale profonde du kyste au contact de ces structures. Le risque
est la récidive à partir de la paroi résiduelle, la suppuration chronique et la fistule biliaire externe. Une
épiplooplastie est recommandée dans cette situation (4). L'approche laparoscopique est une option technique
possible qui a fait la preuve de son efficacité. Les hépatectomies partielles anatomiques peuvent être
indiquées en cas de récidive active complexe. La transplantation hépatique peut être indiquée en cas
d'hépatopathie chronique terminale.
La prévention de la diffusion intrapéritonéale peropératoire du protoscolex pouvant aboutir à une hydatidose
péritonéale gravissime est un point essentiel. Elle repose a) sur l'utilisation d'une solution scolecide en
peropératoire. Le sérum salé hypertonique à 20 % est recommandé par l'OMS pour imbiber les champs et
compresses qui entourent le site opératoire et être mis en contact 15 minutes avec la membrane germinative
du kyste. Son utilisation est contre-indiquée en cas de communication du kyste avec l'arbre biliaire ; b) sur la
prescription d'albendazole (10-15 mg/kg/jour) au minimum 24 heures avant l'intervention.
FCC 19 - Prise en charge des lésions kystiques du foie
L'existence d'une fistule kystobiliaire complique la prise en charge chirurgicale ; Elle est plus fréquente pour
les kystes de plus de 7,5 cm de diamètre (79 % de fistules dans ce cas) et pour les kystes en contact avec le hile
hépatique (48 % de fistules dans ce cas). La détection peropératoire se fait par la coloration biliaire typique du
contenu du kyste et par l'injection de bleu de méthylène pour le repérage topographique de l'orifice fistuleux.
Les options thérapeutiques sont la suture directe, le drainage biliaire externe transfistulaire ou une
hépatectomie réglée radicale. La sphinctérotomie postopératoire isolée ne permet pas de régler le problème
dans tous les cas surtout en cas de périkystectomie partielle et la fermeture spontanée n'est pas habituelle.
La PAIR est une technique mini-invasive moins onéreuse et surtout développée en zone endémique.
Elle comporte 4 temps :
1) Ponction percutanée du kyste sur contrôle échographique par voie transhépatique
2) Aspiration du contenu liquide
3) Injection de protoscolecide (Nacl 20 % ou alcool à 95 %) pendant 15 minutes
4) Réaspiration du liquide.
Le traitement par albendazole est indiqué 4 heures avant et pendant un mois après. Le risque de
choc anaphylactique est identique à la chirurgie. La PAIR est indiquée pour les kystes de plus de 5
cms de diamètre CE1, CE3a et les lésions kystiques indifférenciées. Elle est contre-indiquée en cas de
fistule biliaire et pour les autres types échographiques. Chez la femme enceinte et les enfants de
moins de 3 ans son indication n'est pas recommandée.
c. Le traitement médical seul est indiqué pour les petits kystes (< 5 cms) CE1, CE3a et lésions kystiques
indifférenciées, les lésions multiples et les patients inopérables. Il est contre indiqué chez la femme
enceinte et les enfants de moins de 3 ans. Il est également recommandé pour un mois comme
prévention des récidives chez les patients opérés.
d. Abstention (« watch and wait option ») : les lésions CE4 et CE5 ne nécessitent pas de traitement de
principe et peuvent faire l'objet d'une surveillance clinico-échographique.
L'échinococcose alvéolaire (EA) réalise habituellement des lésions microkystiques visibles sur les
pièces opératoires. Les grosses lésions kystiques sont rares au stade diagnostic et correspondent le plus
souvent à des cavités nécrotiques abcédées à contenu biliaire. Elle reste rare en France malgré des zones
d'endémie en Franche-Comté, en Savoie, en Lorraine, dans les Ardennes et dans le Massif Central (5).
EA est considérée comme un cancer à développement progressif infiltrant les structures vasculaires et biliaires.
Dans les années 70, elle était considérée comme une maladie incurable du fait du diagnostic tardif au stade
d'ictère (45 % des cas) ou d'hépatomégalie (20 % des cas) associés le plus souvent à une angiocholite à
répétition. De nos jours, du fait du diagnostic plus précoce grâce au dépistage échographique de lésions
asymptomatiques et des progrès de la chirurgie hépatique, près de 50 % des patients peuvent être guéris par la
chirurgie radicale (1).
FCC 19 - Prise en charge des lésions kystiques du foie
Il n'y a pratiquement plus d'indication pour la chirurgie palliative en particulier la résection palliative partielle
décrite par les auteurs Russes dans les années 60 ou les drainages chirurgicaux d'abcès ou les dérivations
hépatobiliaires. Les procédés non opératoires doivent être préférés (stent biliaire endoscopique, drainage
d'abcès percutané sous contrôle échographique) parfois comme préparation à une chirurgie radicale.
La résection partielle à visée curative (R0) est le traitement considéré comme le « gold standart » qui va donner
les meilleures chances de survie aux patients (6).
Pour les patients dépistés asymptomatiques, la résection R0 est réalisable pour pratiquement tous les malades
en particulier en cas de lésions périphériques avec un faible risque de mortalité postopératoire (< 1%) et une
survie sans récidive à 10 ans de 100 %. Pour les lésions centrales nécessitant une résection hépatique majeure
à risque d'insuffisance hépatique postopératoire, le traitement parasitostatique par benzimidazole doit être
considéré en premier.
Pour les cas symptomatiques ou compliqués, les hépatectomies majeures élargies avec reconstructions biliaires
intrahépatiques et vasculaires (portales ou caves inférieures) comme dans les tumeurs de Klatskin sont
indiquées. Une résection diagphragmatique est nécessaire dans 1/3 des cas. Une insuffisance hépatique
postopératoire est inhabituelle en raison de l'hypertrophie progressive du foie restant liée à la thrombose
parasitaire fréquente de la branche portale du côté opposé. La morbidité postopératoire est inférieure à 5 % et
la survie à 10 ans sans récidive est de 80 %.
La transplantation hépatique (TH) doit être considérée en cas de lésion bifocale volumineuse, de syndrome de
Budd Chiari chronique ou de cirrhose biliaire secondaire avec angiocholite à répétition menaçant la vie du
patient (7). Pour indiquer une TH, les principales conditions sont l'impossibilité de réaliser une résection
radicale partielle et l'absence d'atteinte extrahépatique à distance (poumons, cerveau, cœur). Pour réduire le
risque de récidive un traitement par albendazole pré et post-TH ainsi qu'un traitement immunusuppresseur
« allégé » sont recommandés. Pour des patients très sélectionnés (< 5 % des cas), la survie à 10 ans sans
récidive est de 58 % ce qui est mieux qu'en cas d'indication de TH pour carcinome hépatocellulaire dans le
registre européen des greffes hépatiques.
Avec ce type d'approche incluant le traitement périopératoire par albendazole et un suivi au long court par des
équipes spécialisées, il a été démontré que la réduction d'espérance de vie liée à EA était passée de 18,2 ans
chez les hommes et 21 ,3 ans chez les femmes en 1970 à respectivement 3,5 ans et 2,6 ans de nos jours (8).
1. Brunetti E et al. Expert Consensus for the diagnosis and treatment of cystic and alveolar
echinococcosis in humans. Acta Trop ; 2010 : 1-16.
FCC 19 - Prise en charge des lésions kystiques du foie
2. WHO Informal Working Group, Acta Trop ; 2003 : 253-61.
3. Junghans S et al, Am J Trop Med Hyg ; 2008 : 301-11.
4. Dzini Ch et al, World J Surg ; 2004 : 731-6.
5. Vuitton DA, Presse Med ; 2010 : 216-30.
6. Kadry Z et al, Br J Surg ; 2005 : 1110-6.
7. Koch S et al, Transplantation ; 2003 : 856-63.
8. Torgerson P et al, J Hepatol ; 2008 : 72-7.
FCC 19 - Prise en charge des lésions kystiques du foie
Source: http://www.chirurgie-viscerale.fr/Data/upload/files/FCC19%20mise%20en%20page.pdf
Ontario East Marine Surveys 3589 Battersea Road RR2 Inverary, On K0H 1X0 Surveyors Report Report Number: Date of Inspection: Commissioned by: Address: 6522 Bedford Road, RR1 Sydenham, ON K0H 2T0 General Information Make of Vessel Alberg 30, Whitby Boat Works
Contents lists available at Journal of Experimental and Clinical Medicine Metformin as a Novel Component of Metronomic Chemotherapeutic Use:A Hypothesis Jorge Eduardo Duque , Juliana Velez Ismael Samudio Enoch Lai 1 Grupo de Terapia Celular y Molecular, Pontificia Universidad Javeriana, Bogotá DC, Colombia 2 Centro Oncológico de Antioquia, Medellín, Colombia3 Shuang Ho Medical Hospital, Taipei Medical University, Taipei, Taiwan






