Viagra gibt es mittlerweile nicht nur als Original, sondern auch in Form von Generika. Diese enthalten denselben Wirkstoff Sildenafil. Patienten suchen deshalb nach viagra generika schweiz, um ein günstigeres Präparat zu finden. Unterschiede bestehen oft nur in Verpackung und Preis.
Victoza pm fr
VICTOZA®
Solution injectable dans un stylo prérempli
GLP-1 (
glucagon like peptide-1) humain
Novo Nordisk Canada Inc.
Date de révision :
2680, avenue Skymark, bureau 300
Mississauga (Ontario) L4W 5L6
Numéro de contrôle de la présentation :
Date d'approbation :
Monographie de VICTOZA® (liraglutide)
Page 1 sur 62
Table des matières
Monographie de VICTOZA® (liraglutide)
Page 2 sur 62
VICTOZA®
PARTIE I : RENSEIGNEMENTS POUR LE PROFESSIONNEL DE LA SANTÉ
RENSEIGNEMENTS SOMMAIRES SUR LE PRODUIT
Forme posologique et
Ingrédients non médicinaux cliniquement
d'administration
Solution injectable,
Phosphate disodique dihydraté,
propylèneglycol, phénol et eau pour injection.
Pour la liste complète des ingrédients, voir la section Formes posologiques, composition et conditionnement.
DESCRIPTION
VICTOZA® contient du liraglutide, un analogue du GLP-1 humain, qui agit comme agoniste du
récepteur du GLP-1. Le précurseur peptidique du liraglutide, produit à l'aide d'un procédé
comprenant l'expression de l'ADN recombiné dans
Saccharomyces cerevisiae, a été mis au point
en substituant l'arginine à la lysine à la position 34, afin d'obtenir 97 % d'homologie avec le
GLP-1 humain naturel. Le liraglutide est obtenu en rattachant un acide gras à 16 atomes de
carbone (acide palmitique) à un espaceur (acide glutamique) situé sur le résidu de lysine à la
position 26 du précurseur peptidique.
VICTOZA® est une solution transparente et incolore. Un mL de solution VICTOZA® contient
6 mg de liraglutide. Chaque stylo prérempli contient 3 mL de solution VICTOZA®, ce qui
équivaut à 18 mg de liraglutide anhydre sans sel.
INDICATIONS ET UTILISATION CLINIQUE
VICTOZA® est indiqué pour administration uniquotidienne dans le traitement des adultes diabétiques de type 2 afin d'améliorer le contrôle glycémique en association avec :
la metformine, quand un régime alimentaire et l'exercice plus la dose maximale tolérée
de metformine n'ont pas contrôlé adéquatement la glycémie;
la metformine et une sulfonylurée, quand un régime alimentaire et l'exercice plus une
bithérapie avec la metformine et une sulfonylurée n'ont pas contrôlé adéquatement la glycémie;
la metformine et une insuline basale, quand un régime alimentaire et l'exercice plus une
bithérapie avec VICTOZA® et la metformine n'ont pas contrôlé adéquatement la glycémie (voir ESSAIS CLINIQUES).
Monographie de VICTOZA® (liraglutide)
Page 3 sur 62
L'utilisation de VICTOZA® en association avec une insuline prandiale (à courte durée d'action) n'a pas été étudiée.
VICTOZA® ne remplace pas l'insuline. VICTOZA® ne doit pas être utilisé dans le diabète de type 1 (appelé antérieurement diabète insulino-dépendant ou DID).
Gériatrie (> 65 ans) : Au cours des essais cliniques, aucune différence d'efficacité n'a été
observée chez les sujets âgés de 65 ans ou plus. Il est possible que les patients de plus de 70 ans
ressentent plus d'effets secondaires gastro-intestinaux quand ils sont traités avec VICTOZA®.
L'expérience thérapeutique acquise chez les patients âgés de 75 ans ou plus est limitée. (Voir
MISES EN GARDE ET PRÉCAUTIONS – Populations particulières – Gériatrie; EFFETS
INDÉSIRABLES – Aperçu des effets indésirables du médicament, Effets indésirables du
médicament observés au cours des essais cliniques – Effets secondaires gastro-intestinaux; et
POSOLOGIE ET ADMINISTRATION – Posologie recommandée et ajustement posologique –
Gériatrie).
Pédiatrie (< 18 ans) : L'innocuité et l'efficacité de VICTOZA® n'ont pas été évaluées chez les
patients âgés de moins de 18 ans. VICTOZA® n'est pas indiqué chez les patients de moins de
18 ans (voir MISES EN GARDE ET PRÉCAUTION – Population particulière – Pédiatrie).
CONTRE-INDICATIONS
1. VICTOZA® est contre-indiqué chez les patients ayant des antécédents personnels ou
familiaux de carcinome médullaire de la thyroïde et chez les patients atteints d'une adénomatose pluri-endocrinienne de type 2.
2. VICTOZA® est contre-indiqué chez les patients qui présentent une hypersensibilité au
liraglutide ou à l'un des ingrédients de la formule. Pour la liste complète des ingrédients, voir la section FORMES POSOLOGIQUES, COMPOSITION ET CONDITIONNEMENT de la monographie.
3. VICTOZA® est contre-indiqué chez les femmes enceintes ou qui allaitent.
MISES EN GARDE ET PRÉCAUTIONS
Mises en garde et précautions importantes
Risque de tumeurs des cellules C de la thyroïde
Le liraglutide cause des tumeurs des cellules C de la thyroïde, qui dépendent de la dose et de
la durée du traitement, chez des rats et des souris des deux sexes, à des expositions cliniquement pertinentes (voir la section TOXICOLOGIE de la PARTIE II). On ignore si le liraglutide peut causer des tumeurs des cellules C de la thyroïde, y compris des carcinomes médullaires de la thyroïde, chez l'humain, car les études cliniques et les études non cliniques n'ont pas permis d'exclure une pertinence pour l'humain.
VICTOZA® est contre-indiqué chez les patients ayant des antécédents personnels ou
familiaux de carcinome médullaire de la thyroïde et chez les patients atteints du syndrome de
Monographie de VICTOZA® (liraglutide)
Page 4 sur 62
néoplasie endocrinienne multiple de type 2. Sur la base des constatations relevées chez des
rongeurs, une surveillance par le dosage de la calcitonine ou une échographie thyroïdienne a
été effectuée durant les essais cliniques, ce qui est susceptible d'avoir augmenté le nombre de
thyroïdectomies inutiles. On ignore si la surveillance par le dosage de la calcitonine ou une
échographie thyroïdienne réduira le risque de tumeur des cellules C de la thyroïde chez
l'humain. Les patients devraient être conseillés au sujet du risque de tumeurs de la thyroïde et
renseignés sur leurs symptômes (voir
CONTRE-INDICATIONS, MISES EN GARDE ET
PRÉCAUTIONS, EFFETS INDÉSIRABLES et
TOXICOLOGIE).
Carcinogenèse et mutagenèse Risque de tumeurs des cellules C de la thyroïde
VICTOZA® cause des tumeurs des cellules C de la thyroïde (adénomes ou carcinomes), qui
dépendent de la dose et de la durée du traitement, chez des rats et des souris des deux sexes, à
des expositions cliniquement pertinentes (voir la section TOXICOLOGIE de la PARTIE II). Des
carcinomes malins des cellules C de la thyroïde ont été détectés chez des rats et des souris. Une
augmentation statistiquement significative du taux de cancer a été observée chez des rats
recevant le liraglutide à 8 fois l'exposition humaine, par rapport aux témoins. On ignore si
VICTOZA® peut causer des tumeurs des cellules C de la thyroïde, y compris des carcinomes
médullaires de la thyroïde, chez l'humain, car les études cliniques et les études non cliniques
n'ont pas permis de déterminer la pertinence clinique des tumeurs murines causées par le
liraglutide.
Durant les essais cliniques, on a rapporté 6 cas d'hyperplasie des cellules C de la thyroïde chez
les patients sous VICTOZA® et 2 cas chez les patients sous comparateur (1,3 contre 1,0 cas pour
1000 années-patients). Dans le cas d'un patient sous comparateur ayant un carcinome médullaire
de la thyroïde, le taux sérique de calcitonine était > 1000 ng/L avant son traitement, ce qui
évoque une maladie préexistante. Tous ces cas ont été diagnostiqués après une thyroïdectomie
qui avait été effectuée à cause de résultats anormaux obtenus à l'occasion de dosages réguliers de
la calcitonine qui étaient prévus dans le protocole. Cinq des six patients traités avec le liraglutide
avaient des taux élevés de calcitonine au départ et tout le long de l'étude. Un taux élevé de
calcitonine est apparu pendant le traitement chez un patient sous VICTOZA® et un patient d'un
autre groupe. (Voir Effets indésirables du médicament observés au cours des essais cliniques
sous EFFETS INDÉSIRABLES).
Il est important d'informer les patients du risque de carcinome médullaire de la thyroïde et des
symptômes d'une tumeur de la thyroïde, comme une dysphagie, une dyspnée, un enrouement
persistant ou la présence d'une masse dans le cou. En raison de la spécificité peu élevée du
dosage sérique de la calcitonine et de la fréquence généralement élevée des maladies de la
thyroïde, on ignore si la surveillance par l'échographie de la thyroïde ou le dosage de la
calcitonine permettra de diminuer le risque de carcinome médullaire de la thyroïde, et cette
surveillance risque d'augmenter le nombre d'interventions inutiles. Si un examen physique ou
une échographie du cou effectué pour une raison autre qu'un cancer met en évidence des nodules
de la thyroïde, le patient doit consulter un endocrinologue pour subir des examens
Monographie de VICTOZA® (liraglutide)
Page 5 sur 62
supplémentaires. Bien que la pertinence de la surveillance régulière du taux sérique de
calcitonine soit incertaine chez les patients traités avec VICTOZA®, les patients ayant un taux
élevé de calcitonine doivent consulter un endocrinologue pour subir des examens
supplémentaires. (Voir Aperçu des effets indésirables du médicament et Effets indésirables du
médicament observés au cours des essais cliniques sous EFFETS INDÉSIRABLES).
Système cardiovasculaire
Augmentation de la fréquence cardiaque : Une augmentation moyenne sur 24 heures de 7-
8 battements cardiaques par minute a été constatée avec VICTOZA® dans le cadre d'une étude
menée chez des sujets sains qui subissaient des ECG en série (voir Électrophysiologie cardiaque
sous MODE D'ACTION ET PHARMACOLOGIE CLINIQUE). Chez les patients diabétiques,
une hausse du pouls moyen de 2-4 battements par minute a été observée lors des essais cliniques
de longue durée. En raison de l'expérience clinique limitée acquise chez des patients ayant des
maladies cardiaques susceptibles d'être aggravées par une augmentation de la fréquence
cardiaque, telles qu'une cardiopathie ischémique ou une tachyarythmie, la prudence est de mise
chez ces patients (voir INTERACTIONS MÉDICAMENTEUSES). Dans l'ensemble des essais
cliniques menés chez des patients diabétiques, l'incidence d'un critère composite de
tachyarythmie quelconque était plus élevée pour VICTOZA® que pour le placebo (voir Système
cardiovasculaire sous EFFETS INDÉSIRABLES).
Allongement de l'intervalle PR : Un allongement de l'intervalle PR moyen allant jusqu'à
10 ms a été constaté chez des sujets sains recevant VICTOZA® pendant une étude clinique (voir
Électrophysiologie cardiaque sous MODE D'ACTION ET PHARMACOLOGIE CLINIQUE).
Chez les volontaires sains et les patients diabétiques, l'incidence d'un bloc auriculo-ventriculaire
du premier degré était plus élevée avec VICTOZA® qu'avec le placebo (voir Électrophysiologie
cardiaque sous MODE D'ACTION ET PHARMACOLOGIE CLINIQUE et Système
cardiovasculaire sous EFFETS INDÉSIRABLES). L'importance clinique de ces changements
n'est pas parfaitement connue. En raison de l'expérience limitée acquise chez des patients ayant
déjà une anomalie du système de conduction (comme un bloc auriculo-ventriculaire du premier
degré marqué ou du deuxième ou troisième degré) ou un trouble du rythme cardiaque (comme
une tachyarythmie), la prudence est de mise chez ces patients (voir INTERACTIONS
MÉDICAMENTEUSES).
Généralités
VICTOZA® ne remplace pas l'insuline. VICTOZA® ne doit pas être administré aux patients
atteints de diabète de type 1, ni être utilisé dans le traitement de l'acidocétose diabétique.
VICTOZA® ne doit pas être administré par voie intramusculaire ou intraveineuse.
Ne jamais partager un stylo VICTOZA® entre les patients.
Le stylo VICTOZA® ne doit jamais être partagé entre les patients, même si l'aiguille a été
changée. Le partage présente un risque de transmission de pathogènes à diffusion hématogène.
Monographie de VICTOZA® (liraglutide)
Page 6 sur 62
Système endocrinien et métabolisme Hypoglycémie
Les patients recevant VICTOZA® en association avec une sulfonylurée sont susceptibles de
présenter un risque accru d'hypoglycémie. Au cours des essais cliniques d'une durée de
26 semaines ou plus, un épisode d'hypoglycémie majeure dont le traitement a nécessité l'aide
d'une autre personne est survenu chez 8 patients traités avec VICTOZA®. Au cours d'un autre
essai clinique comparant VICTOZA® + metformine à la sitagliptine + metformine (essai
NN2211-1860), un autre épisode d'hypoglycémie majeure a été signalé chez un patient traité
avec VICTOZA®. Au total, 9 patients traités avec VICTOZA® dans le cadre de ces essais
cliniques ont fait une hypoglycémie majeure. Six de ces patients prenaient une sulfonylurée en
plus de VICTOZA® (voir Hypoglycémie sous EFFETS INDÉSIRABLES). On peut réduire le
risque d'hypoglycémie en diminuant la dose de la sulfonylurée.
Pancréatite
D'après des rapports de pharmacovigilance non sollicités, des cas de pancréatite aiguë ont été
observés chez des patients traités par VICTOZA®, y compris des cas mortels et non mortels de
pancréatite hémorragique ou nécrosante. Au cours des essais cliniques effectués sur des adultes
atteints de diabète de type 2, plus de cas de pancréatite ont été rapportés dans le groupe traité
avec VICTOZA® que dans le groupe sous comparateur (2,7 contre 0,5 cas pour 1000 années-
patients).
[Cas inclus dans le total] Dans le groupe traité avec VICTOZA®, un cas mortel de
pancréatite nécrosante a été observé (voir Pancréatite sous EFFETS INDÉSIRABLES). La
relation de causalité entre la pancréatite et VICTOZA® n'a pas été élucidée. Au début du
traitement par VICTOZA® et quand on augmente la dose, il y a lieu d'observer les patients de
près au cas où des signes ou des symptômes de pancréatite apparaîtraient (y compris des
douleurs abdominales intenses persistantes ou intermittentes, irradiant parfois vers le dos et
accompagnées ou non de vomissements). Si on soupçonne une pancréatite, il faut interrompre
rapidement le traitement par VICTOZA® et tout autre médicament potentiellement suspect,
procéder à des tests de confirmation et instaurer un traitement approprié. Si une pancréatite est
confirmée, le traitement par VICTOZA® ne doit pas être repris. La prudence est de mise chez les
patients ayant des antécédents de pancréatite. Il faudrait envisager le recours à des traitements
antidiabétiques autres que VICTOZA® chez les patients ayant des antécédents de pancréatite.
Populations particulières Femmes enceintes : Aucune étude sur Victoza® n'a été réalisée chez des femmes enceintes. Les
études animales ont mis en évidence des effets toxiques sur la reproduction et le développement,
y compris des effets tératogènes, à 0,8 fois l'exposition clinique ou plus (voir TOXICOLOGIE à
la PARTIE II).
VICTOZA® ne doit pas être administré durant la grossesse (voir CONTRE-INDICATIONS). Si
une patiente souhaite tomber enceinte ou si elle est tombe enceinte, le traitement par le
liraglutide doit être interrompu.
Monographie de VICTOZA® (liraglutide)
Page 7 sur 62
Femmes qui allaitent : On ignore si Victoza® passe dans le lait humain. Chez des animaux qui
allaitaient, VICTOZA® est passé inchangé dans le lait. Étant donné que de nombreux
médicaments passent dans le lait humain et que des études animales ont révélé la possibilité que
le liraglutide soit tumorigène, les femmes qui allaitent doivent interrompre le traitement par
VICTOZA® (voir TOXICOLOGIE à la PARTIE II).
Pédiatrie (< 18 ans) : L'innocuité et l'efficacité de VICTOZA® n'ont pas été évaluées chez des
patients âgés de moins de 18 ans. VICTOZA® n'est pas indiqué dans le traitement du diabète de
type 2 chez les patients âgés de moins de 18 ans.
Gériatrie (> 65 ans) : Les essais cliniques de VICTOZA® ont regroupé 797 (20 %) patients âgés
de 65 ans ou plus, dont 113 (2,8 %) âgés de 75 ans ou plus. Aucune différence d'efficacité n'a
été observée entre les sujets de 65 ans ou plus et les sujets plus jeunes de ces études cliniques.
Les patients âgés de plus de 70 ans ont ressenti plus d'effets secondaires gastro-intestinaux
quand ils étaient traités par Victoza®. (Voir EFFETS INDÉSIRABLES – Aperçu des effets
indésirables du médicament – Effets indésirables gastro-intestinaux; POSOLOGIE ET
ADMINISTRATION – Posologie recommandée et ajustement posologique – Gériatrie; MODE
D'ACTION ET PHARMACOLOGIE CLINIQUE – Populations particulières et états
pathologiques – Gériatrie [> 65 ans]).
Maladies cardiovasculaires - Patients atteints d'un IM récent, d'angine instable ou
d'insuffisance cardiaque congestive : Les patients atteints d'un infarctus du myocarde aigu
dans les 6 derniers mois, d'une maladie cardiaque cliniquement importante, d'angine de poitrine
instable ou d'insuffisance cardiaque congestive (classe III ou IV selon la NYHA) n'ont pas été
évalués dans les essais cliniques de VICTOZA®. Par conséquent, VICTOZA® doit être
administré avec prudence à ces patients
.
Insuffisance hépatique : L'innocuité et l'efficacité de VICTOZA® n'ont pas été évaluées chez
les patients atteints d'insuffisance hépatique. L'administration de VICTOZA® à ces patients n'est
pas recommandée.
Insuffisance rénale : L'expérience clinique sur l'administration de VICTOZA® en présence
d'une insuffisance rénale légère ou modérée est limitée. Il n'y a pas ou à peu près pas
d'expérience clinique sur l'administration de VICTOZA® à des patients atteints d'insuffisance
rénale grave, voire terminale; l'administration de VICTOZA® à ces patients n'est pas
recommandée (voir POSOLOGIE ET ADMINISTRATION – Posologie recommandée et
ajustement posologique – Insuffisance rénale; MODE D'ACTION ET PHARMACOLOGIE
CLINIQUE – Populations particulières et états pathologiques – Insuffisance rénale).
Les patients traités par VICTOZA® doivent être mis au courant du risque de déshydratation relié
aux effets secondaires gastro-intestinaux du produit et doivent prendre des précautions pour
éviter la déshydratation. Des cas d'insuffisance ont été signalés, habituellement en association
avec des nausées et vomissements, une diarrhée ou une déshydratation ayant parfois nécessité
Monographie de VICTOZA® (liraglutide)
Page 8 sur 62
une hémodialyse. L'instauration d'un traitement par VICTOZA® ou l'augmentation des doses de
VICTOZA® en présence d'une insuffisance rénale commande la prudence (voir EFFETS
INDÉSIRABLES).
Troubles gastro-intestinaux : L'emploi de VICTOZA® est associé à des réactions indésirables
gastro-intestinales temporaires, comme des nausées, des vomissements et la diarrhée (voir
EFFETS INDÉSIRABLES – Aperçu des effets indésirables du médicament et Effets indésirables
du médicament observés au cours des essais cliniques – Effets indésirables gastro-intestinaux).
L'innocuité de VICTOZA® n'a pas été étudiée chez des sujets atteints d'une maladie intestinale
inflammatoire ou de gastroparésie diabétique. VICTOZA® ne doit pas être administré à ces
patients.
Réactions d'hypersensibilité : Des rapports de pharmacovigilance ont fait état de réactions
d'hypersensibilité graves (réactions anaphylactiques et œdème de Quincke, par exemple) chez
des patients traités par VICTOZA®. Si une réaction d'hypersensibilité survient, le patient doit
cesser de prendre VICTOZA® et tout autre médicament possiblement responsable de la réaction
et consulter un médecin sans tarder.
Des cas d'œdème de Quincke ont été signalés avec d'autres agonistes du récepteur du GLP-1
aussi. La prudence est de mise chez les patients ayant présenté un œdème de Quincke lors de
l'utilisation d'un autre agoniste du récepteur du GLP-1 puisqu'on ignore si ces patients seront
prédisposés à réagir de la même façon à VICTOZA®.
Surveillance et examens de laboratoire Il n'est pas nécessaire de surveiller régulièrement la glycémie pour ajuster la dose de
VICTOZA®. En revanche, au moment de l'instauration du traitement par VICTOZA® en
association avec une sulfonylurée, l'autosurveillance de la glycémie peut être nécessaire pour
diminuer la dose de la sulfonylurée afin de réduire le risque d'hypoglycémie.
Les patients doivent toutefois être informés du fait qu'il convient de surveiller la réponse à tout
traitement antidiabétique à l'aide de mesures périodiques du taux d'A1C, dans le but de
rapprocher ce taux de la normale. Le taux d'A1C est particulièrement utile pour l'évaluation du
contrôle glycémique à long terme.
EFFETS INDÉSIRABLES
Aperçu des effets indésirables du médicament
Au cours des essais cliniques de longue durée, les effets indésirables les plus fréquents étaient
des troubles gastro-intestinaux, des infections ainsi que des troubles du système nerveux. L'arrêt
du traitement pour effet indésirable a été plus fréquent avec VICTOZA® (7,8 %) qu'avec les
comparateurs (3,4 %). Cette différence s'explique par les retraits dus aux troubles gastro-
intestinaux.
Monographie de VICTOZA® (liraglutide)
Page 9 sur 62
Dans le cadre d'un autre essai clinique comparant VICTOZA® plus la metformine à la
sitagliptine plus la metformine (essai NN2211-1860), 14 (6,2 %), 15 (6,8 %) et 4 (1,8 %) patients
ont interrompu le traitement en raison d'effets indésirables dans les groupes recevant
respectivement 1,2 mg de liraglutide, 1,8 mg de liraglutide et la sitagliptine, chacun en
association avec la metformine. La plupart de ces interruptions sont survenues au cours du
premier mois du traitement.
Une proportion semblable de patients traités avec VICTOZA® et de patients recevant d'autres
traitements ont présenté des effets indésirables graves (5,7 % et 5,6 %); il s'agissait le plus
souvent de troubles cardiaques (19,6 et 18,9 épisodes pour 1000 sujets-années). Au cours de
l'essai 1860, des effets indésirables graves ont été observés chez 2,7 %, 2,8 % et 1,8 % des
patients traités respectivement avec 1,2 mg de Victoza®, 1,8 mg de Victoza® et la sitagliptine,
chacun en association avec la metformine.
Effets indésirables du médicament observés au cours des essais cliniques Puisque les essais cliniques sont menés dans des conditions très particulières, les taux d'effets
indésirables observés durant ces essais peuvent ne pas refléter les taux observés en pratique et
ne doivent pas être comparés aux taux rapportés dans le cadre d'essais cliniques portant sur un
autre médicament. Les renseignements sur les effets indésirables d'un médicament qui sont tirés
des essais cliniques sont utiles pour déterminer les effets indésirables d'un médicament et pour
en estimer la fréquence.
Le tableau 1 présente la liste des effets indésirables qui sont apparus en cours de traitement à une
fréquence > 1 % durant deux essais cliniques (1572 et 1697) d'une durée de 26 semaines sur
VICTOZA® en association, peu importe la relation de causalité établie par l'investigateur. Le
premier essai clinique comparatif, LEADMC 2-1572, portait sur VICTOZA® utilisé en association
avec la metformine. Le second, LEADMC 5-1697, portait sur VICTOZA® utilisé en association
avec la metformine et une sulfonylurée (voir ESSAIS CLINIQUES à la PARTIE II).
Tableau 1 : Effets indésirables apparus en cours de traitement pendant les essais cliniques 1572 et 1697 d'une durée de
26 semaines sur VICTOZA® en association
Essai 1572 (LEADMC 2)
Essai 1697 (LEADMC 5)
Placebo +
Comparateur
Placebo +
Comparateur
Victoza® +
Victoza® +
Victoza® +
metformine actif
Victoza® +
metformine
metformine
metformine
metformine
(metformine
metformine
(insuline
glargine +
metformine +
glimépiride)
Population
d'innocuité
Troubles du sang et
du système
lymphatique
Troubles de l'oreille
et du labyrinthe
Monographie de VICTOZA® (liraglutide)
Page 10 sur 62
Essai 1572 (LEADMC 2)
Essai 1697 (LEADMC 5)
Placebo +
Comparateur
Placebo +
Comparateur
Victoza® +
Victoza® +
Victoza® +
metformine actif
Victoza® +
metformine
metformine
metformine
metformine
(metformine
metformine
(insuline
glargine +
metformine +
glimépiride)
Troubles de la vue
angiosclérotique
Blessure,
empoisonnement et
complications de
Lésions des tissus
intestinaux
Douleur dans le haut
Douleur abdominale
Malaise abdominal
Gêne dans l'épigastre
œsophagien
Troubles généraux et
réactions au point
d'injection
Syndrome d'allure
Satiété précoce
Douleur thoracique
Troubles
Stéatose hépatique
Troubles du système
immunitaire
Allergie saisonnière
Infections et
Infection des voies
Monographie de VICTOZA® (liraglutide)
Page 11 sur 62
Essai 1572 (LEADMC 2)
Essai 1697 (LEADMC 5)
Placebo +
Comparateur
Placebo +
Comparateur
Victoza® +
Victoza® +
Victoza® +
metformine actif
Victoza® +
metformine
metformine
metformine
metformine
(metformine
metformine
(insuline
glargine +
metformine +
glimépiride)
Amygdalite aiguë
Infection des voies
Infection des voies
Gastro-entérite
Infection urinaire
Infection virale
Hausse de la créatine
calcitonine sanguine
Hausse du rapport
Hausse de la pression
Troubles du
métabolisme et de la
nutrition
Perte d'appétit
Troubles des tissus
et conjonctifs
Spasmes musculaires
musculosquelettiques
Troubles du système
Étourdissements
Monographie de VICTOZA® (liraglutide)
Page 12 sur 62
Essai 1572 (LEADMC 2)
Essai 1697 (LEADMC 5)
Placebo +
Comparateur
Placebo +
Comparateur
Victoza® +
Victoza® +
Victoza® +
metformine actif
Victoza® +
metformine
metformine
metformine
metformine
(metformine
metformine
(insuline
glargine +
metformine +
glimépiride)
Troubles
Troubles
thoraciques et
pharyngolaryngées
Troubles de la peau
et des tissus sous-
cutanés
Éruption cutanée
Troubles vasculaires
Calcification aortique
Artériosclérose
Le tableau 2 présente la liste des effets indésirables qui sont apparus en cours de traitement à une fréquence > 1 % pendant l'essai NN2211-1860 d'une durée de 26 semaines, peu importe la relation de causalité établie par l'investigateur. Dans cet essai clinique comparatif sur VICTOZA®, chaque médicament à l'étude s'ajoutait à la metformine (voir ESSAIS CLINIQUES à la PARTIE II).
Monographie de VICTOZA® (liraglutide)
Page 13 sur 62
Tableau 2 : Effets indésirables apparus en cours de traitement (à une fréquence ≥ 1 %) pendant l'essai 1860
1,2 mg de Victoza®
1,8 mg de Victoza®
100 mg de sitagliptine
+ metformine
+ metformine
+ metformine
Terme privilégié
Troubles gastro-intestinaux
Reflux gastro-œsophagien pathologique
Ballonnement abdominal
Douleur dans le haut de l'abdomen
Malaise abdominal
Douleur abdominale
Infections et infestations
Rhinopharyngite
Infection des voies respiratoires supérieures
Gastro-entérite
Infection des voies urinaires
Infection des voies respiratoires inférieures
Troubles du système nerveux
Étourdissements
Neuropathie diabétique
Troubles des tissus musculosquelettiques et
conjonctifs
Dorsalgie
Spasmes musculaires
Douleurs aux extrémités
Douleurs musculosquelettiques
Troubles généraux et réactions au point
d'injection
Fatigue
Hématome au point d'injection
Troubles du métabolisme et de la nutrition
Perte d'appétit
Hyperlipidémie
Hausse de la calcitonine sanguine
Hausse de la protéine C-réactive
Monographie de VICTOZA® (liraglutide)
Page 14 sur 62
1,2 mg de Victoza®
1,8 mg de Victoza®
100 mg de sitagliptine
+ metformine
+ metformine
+ metformine
Terme privilégié
Troubles respiratoires, thoraciques et
médiastinaux
Douleurs oropharyngées
Congestion nasale
Blessures, empoisonnement et complications de
l'administration
Contusion
Troubles de la peau et des tissus sous-cutanés
Éruption cutanée
Troubles vasculaires
Troubles cardiaques
Troubles de la vue
Rétinopathie diabétique
Troubles psychiatriques
Troubles endocriniens
Le tableau 3 présente la liste des effets indésirables qui sont apparus en cours de traitement à une fréquence > 1 % pendant l'essai NN2211-1842 d'une durée de 52 semaines (phases principale et de prolongation), peu importe la relation de causalité établie par l'investigateur. Dans cet essai clinique comparatif, VICTOZA® à 1,8 mg s'employait avec la metformine ou l'insuline détémir (voir ESSAIS CLINIQUES à la PARTIE II).
Tableau 3 : Effets indésirables apparus en cours de traitement (à une fréquence ≥ 1 %) pendant l'essai 1842 (phases
principale et de prolongation)
1,8 mg de Victoza®
Levemir® (insuline
Sujets non
+ metformine
détémir) + 1,8 mg de
randomisés
Victoza®
Terme privilégié
Infections et infestations
Rhinopharyngite
Infection des voies respiratoires supérieures
Gastro-entérite virale
Infection des voies urinaires
Infection des voies respiratoires inférieures
Infection dentaire
Gastro-entérite
Infection virale des voies respiratoires
Monographie de VICTOZA® (liraglutide)
Page 15 sur 62
1,8 mg de Victoza®
Levemir® (insuline
Sujets non
+ metformine
détémir) + 1,8 mg de
randomisés
Victoza®
Terme privilégié
Abcès dentaire
Infection virale
Troubles gastro-intestinaux
Douleur dans le haut de l'abdomen
Douleur abdominale
Ballonnement abdominal
Malaise abdominal
Reflux gastro-œsophagien pathologique
Hernie abdominale
Hausse des taux de lipase
Hausse de l'amylase sanguine
Hausse de la créatine kinase sanguine
Hausse de la leucocytémie
Hausse de l'urée sanguine
Hausse de l'alanine aminotransférase
Hausse de la calcitonine sanguine
Troubles généraux et réactions au point
d'injection
Hématome au point d'injection
Réaction au point d'injection
Syndrome d'allure grippale
Blessures, empoisonnement et complications de
Troubles du système nerveux
Étourdissements
Troubles de la peau et des tissus sous-cutanés
Éruption cutanée
Troubles respiratoires, thoraciques et
Monographie de VICTOZA® (liraglutide)
Page 16 sur 62
1,8 mg de Victoza®
Levemir® (insuline
Sujets non
+ metformine
détémir) + 1,8 mg de
randomisés
Victoza®
Terme privilégié
Douleurs oropharyngées
Congestion nasale
Troubles des tissus musculosquelettiques et
conjonctifs
Douleurs aux extrémités
Troubles psychiatriques
Troubles de la vue
Rétinopathie diabétique
Troubles vasculaires
Troubles du métabolisme et de la nutrition
Perte d'appétit
Troubles de l'appareil génital et des seins
Dysfonction érectile
Troubles cardiaques
Bloc auriculo-ventriculaire du premier degré
Troubles de l'oreille et du labyrinthe
Troubles hépatobiliaires
Stéatose hépatique
Troubles du sang et du système lymphatique
Cancer médullaire de la thyroïde : Le taux sérique de calcitonine a été surveillé tout au long
des essais cliniques sur VICTOZA®. La limite inférieure de quantification du dosage sérique de
la calcitonine était de 0,7 ng/L, et la limite supérieure des valeurs de référence était de 5,0 ng/L
pour les femmes et de 8,4 ng/L pour les hommes. Aux semaines 26 et 52 des essais cliniques, le
taux sérique moyen ajusté de calcitonine était plus élevé chez les patients traités avec
VICTOZA® que chez ceux recevant le placebo, mais il n'était pas plus élevé que chez les
patients recevant un comparateur actif. À ces moments des essais, les valeurs moyennes ajustées
du taux sérique de calcitonine se rapprochaient de 1 ng/L et étaient légèrement supérieures à la
limite inférieure de quantification; les différences de moyenne entre les groupes étaient d'environ
0,1 ng/L ou moins. Parmi les patients qui avaient un taux sérique de calcitonine en dessous de la
Monographie de VICTOZA® (liraglutide)
Page 17 sur 62
limite supérieure des valeurs de référence avant le traitement, ceux dont le taux sérique de
calcitonine a augmenté pour dépasser de manière persistante la limite supérieure des valeurs de
référence étaient plus souvent qu'autrement des patients recevant 1,8 mg/jour de VICTOZA®.
La proportion des sujets qui sont passés d'un taux de calcitonine inférieur à la limite supérieure
normale (LSN) des valeurs de référence à un taux dépassant cette limite était de 2,5 % dans le
groupe sous liraglutide, de 1,7 % dans le groupe sous placebo et de 2,0% dans le groupe sous
comparateur actif.
Au cours des essais pendant lesquels le taux sérique de calcitonine en cours de traitement a été
mesuré sur une période maximale de 5 ou 6 mois, une élévation persistante du taux sérique de
calcitonine au-dessus de la limite supérieure des valeurs de référence est apparue chez 1,9 % des
patients recevant 1,8 mg/jour de VICTOZA®, par comparaison avec 0,8 à 1,1 % des patients
prenant un comparateur ou une dose de VICTOZA® de 0,6 mg ou 1,2 mg. Au cours des essais
pendant lesquels le taux sérique de calcitonine a été mesuré sur une période allant jusqu'à
12 mois, 1,3 % des patients recevant 1,8 mg/jour de VICTOZA® et ayant au départ un taux
sérique de calcitonine inférieur ou correspondant aux valeurs de référence ont présenté une
élévation persistante du taux sérique de calcitonine au-dessus de la limite supérieure des valeurs
de référence, comparativement à 0,6 % des patients recevant 1,2 mg de VICTOZA®, 0 % de ceux
recevant le placebo et 1 % de ceux recevant un comparateur actif. Les augmentations du taux
sérique de calcitonine ne dépendaient pas de la dose de VICTOZA® ou de la durée du traitement.
Les patients atteints d'un carcinome médullaire de la thyroïde ont généralement un taux sérique
de calcitonine supérieur à 50 ng/L. Au cours des essais cliniques sur VICTOZA®, des taux
sériques de calcitonine supérieurs à 50 ng/L ont été observés chez un patient recevant
VICTOZA® et chez aucun de ceux prenant un comparateur, parmi tous les patients ayant un taux
de calcitonine inférieur à 50 ng/L avant le traitement. Le patient recevant VICTOZA® et dont le
taux de calcitonine était supérieur à 50 ng/L avait un taux de calcitonine élevé avant le traitement
(10,7 ng/L). Ce dernier a atteint 30,7 ng/L à la semaine 12, puis 53,5 ng/L à la fin de l'essai, au
sixième mois. Plus de 2,5 années après la dernière prise de VICTOZA®, son taux sérique de
calcitonine était de 22,3 ng/L.
L'augmentation la plus importante du taux sérique de calcitonine parmi les patients recevant un
comparateur a été observée chez un patient prenant du glimépiride. Son taux de calcitonine est
passé de 19,3 ng/L au début de l'essai à 44,8 ng/L à la semaine 65, puis à 38,1 ng/L à la
semaine 104.
Parmi les patients ayant un taux sérique de calcitonine inférieur à 20 ng/L au début des essais,
une augmentation du taux de calcitonine à plus de 20 ng/L a été observée chez 0,7 % des patients
recevant VICTOZA®, chez 0,3 % prenant le placebo, chez 0,5 % recevant un comparateur actif
et chez 1,1 % des patients traités avec une dose de 1,8 mg/jour de VICTOZA®. La portée
clinique de ces résultats reste inconnue (voir Mises en garde et précautions importantes et
Carcinogenèse et mutagenèse sous MISES EN GARDE ET PRÉCAUTIONS).
Monographie de VICTOZA® (liraglutide)
Page 18 sur 62
Cancer papillaire de la thyroïde : Dans le cadre des essais cliniques terminés, les taux de
cancer papillaire de la thyroïde étaient de 1,5 (traitement avec le liraglutide) et 0,5 (traitement
sans liraglutide) pour 1000 années-patients d'exposition. Les cancers papillaires (folliculaires) de
la thyroïde étaient plus fréquents chez les patients participant aux essais cliniques sur le
liraglutide que dans la population générale au Canada. Un nombre élevé de patients participant
aux essais cliniques sur le liraglutide ont subi une thyroïdectomie à la suite d'examens de la
thyroïde. La majorité des carcinomes papillaires ont été découverts de manière fortuite à la suite
d'une augmentation du taux sérique de calcitonine qui a entraîné une thyroïdectomie. Tous ces
carcinomes, sauf un, étaient des microcarcinomes de moins de 1,0 cm. Parmi les patients atteints
d'une maladie préexistante de la thyroïde, les taux de néoplasmes de la thyroïde chez les patients
traités avec le liraglutide et chez ceux prenant le placebo étaient semblables, soit respectivement
28,8 et 29,3 cas pour 1000 années-patients. Aucun néoplasme de la thyroïde n'a été observé dans
un groupe recevant un comparateur actif.
Néoplasmes : Au cours des essais cliniques de longue et moyenne durée, 115 nouveaux
néoplasmes ont été signalés, et 45 d'entre eux étaient des néoplasmes malins. Le pourcentage de
patients atteints d'un néoplasme malin ou bénin était de 1,8 % (26,9 cas pour 1000 sujets-années)
pour le liraglutide, de 1,2 % (17 cas pour 1000 sujets-années) pour les comparateurs actifs et de
1,3 % (25,3 cas pour 1000 sujets-années) pour le placebo. Le pourcentage de patients atteints
d'un néoplasme malin était de 0,8 % (10,9 cas pour 1000 sujets-années) pour le liraglutide, de
0,5 % (7,2 cas pour 1000 sujets-années) pour les comparateurs actifs et de 0,3 % (6,3 cas pour
1000 sujets-années) pour le placebo.
Le néoplasme de la thyroïde était le type de néoplasme le plus fréquent. Le pourcentage et le
taux de patients atteints d'un néoplasme bénin de la thyroïde étaient plus élevés chez les sujets
recevant le liraglutide (1,1 % ou 16,0 cas pour 1000 sujets-années) que chez ceux recevant un
comparateur actif (0,6 % ou 9,8 cas pour 1000 sujets-années) ou un placebo (1,0 % ou 19 cas
pour 1000 sujets-années). En ce qui concerne les néoplasmes malins, qui sont plus pertinents sur
le plan clinique, les types de cancer les plus observés chez les patients étaient les cancers de la
prostate, du sein, de la thyroïde, du rectum et du côlon ainsi que le carcinome basocellulaire et
l'adénocarcinome rénal. Les pourcentages de patients atteints d'un cancer de la prostate, du sein
ou du côlon ou d'un adénocarcinome rénal étaient similaires chez les sujets recevant le
liraglutide et ceux recevant l'un ou l'autre des comparateurs. Aucun cas de cancer du rectum ou
de carcinome basocellulaire n'a été observé chez les patients recevant l'un des comparateurs. Les
autres types de néoplasmes malins étaient peu fréquents et leur apparition ne correspondait à
aucun schéma particulier.
Dans une autre étude clinique comparant VICTOZA® + metformine à la sitagliptine +
metformine (essai NN2211-1860), si l'on tient compte de tous les effets indésirables de la
catégorie « Néoplasmes bénins, malins ou non précisés (y compris kystes) » qui ont été rapportés
en 52 semaines, 2 sujets (0,9 %) en ont signalé 2 épisodes; 8 sujets (3,7 %), 9 épisodes et 2 sujets
(0,9 %), 2 épisodes pour les groupes sous 1,2 mg de liraglutide + metformine, 1,8 mg de
Monographie de VICTOZA® (liraglutide)
Page 19 sur 62
liraglutide + metformine et sitagliptine + metformine, respectivement. Parmi ceux-ci,
1 néoplasme malin (carcinome de l'épiglotte) a été signalé dans le groupe sous 1,2 mg de
liraglutide + metformine, 3 néoplasmes malins (cancer du sein, cancer du côlon et carcinome
pancréatique) ont été signalés dans le groupe sous 1,8 mg de liraglutide + metformine et
1 néoplasme malin (cancer du rein) a été signalé dans le groupe sous sitagliptine + metformine.
Aucun cancer de la thyroïde n'a été observé.
Système cardiovasculaire : Au cours des essais réunis de moyenne ou longue durée, y compris
dans les groupes de traitement sans insu, le taux de tachyarythmie quelconque était de 16,5 cas
pour 1000 sujets-années (0,7 %) pour le liraglutide, de 6,1 cas pour 1000 sujets-années (0,2 %)
pour le placebo et de 15,3 cas pour 1000 sujets-années (0,7 %) pour les comparateurs actifs. Le
type de tachyarythmie le plus observé était l'extrasystole. Le taux réuni de fibrillation
auriculaire, de flutter auriculaire, de tachycardie supraventriculaire et d'arythmie
supraventriculaire était de 6,4 épisodes pour 1000 sujets-années avec le liraglutide et de
5,6 épisodes pour 1000 sujets-années avec les comparateurs actifs. Aucun épisode de ce type n'a
été observé avec le placebo. Le taux des effets indésirables de type tachyarythmie qui ont été
rapportés comme des effets indésirables graves était de 2,7, de 0 et de 2,8 pour 1000 sujets-
années respectivement avec VICTOZA®, le placebo et les comparateurs actifs.
Lors des essais réunis de longue durée, le taux de bloc auriculo-ventriculaire du premier degré
était de 2,6 cas pour 1000 sujets-années dans le groupe recevant le liraglutide, de 0 cas pour
1000 sujets-années dans le groupe recevant le placebo et de 1,4 cas pour 1000 sujets-années dans
le groupe recevant un comparateur actif.
Pour ces essais, les investigateurs décidaient si les patients atteints d'une maladie
cardiovasculaire connue d'importance clinique, comme un infarctus du myocarde dans les
6 derniers mois ou une insuffisance cardiaque, étaient exclus. Les patients ayant une
hypertension non contrôlée, traitée ou non (pression artérielle systolique de 180 mm Hg ou
diastolique de 100 mm Hg) étaient exclus de ces essais. (Voir MISES EN GARDE ET
PRÉCAUTIONS – Populations particulières – Maladies cardiovasculaires - Patients atteints d'un
IM récent, d'angine instable ou d'insuffisance cardiaque congestive; INTERACTIONS
MÉDICAMENTEUSES – Interactions médicament-médicament – Médicaments qui augmentent
la fréquence cardiaque et Médicaments qui allongent l'intervalle PR; MODE D'ACTION ET
PHARMACOLOGIE CLINIQUE – Électrophysiologie cardiaque).
Au cours de l'essai 1860, après 26 semaines, des effets indésirables de nature cardiaque avaient
été observés chez 2,7 %, 0,9 % et 0,9 % des patients ayant reçu 1,2 mg de liraglutide +
metformine, 1,8 mg de liraglutide + metformine et la sitagliptine + metformine, respectivement.
Après 52 semaines, des effets indésirables de nature cardiaque étaient survenus chez 4,1 %,
1,8 % et 1,4 % des patients ayant reçu 1,2 mg de liraglutide + metformine, 1,8 mg de liraglutide
+ metformine et la sitagliptine + metformine, respectivement.
Monographie de VICTOZA® (liraglutide)
Page 20 sur 62
Pancréatite : Durant les essais cliniques de VICTOZA®, il y a eu 13 cas de pancréatite chez les
sujets traités par VICTOZA® et 1 cas chez les sujets recevant un comparateur (2,4 contre 0,5 cas
pour 1000 années-patients). Parmi les 13 cas associés à VICTOZA®, il y avait 9 cas de
pancréatite aiguë et 4 cas de pancréatite chronique. Tous les cas étaient graves, sauf un cas de
pancréatite chronique chez un patient recevant VICTOZA®. Un cas mortel de pancréatite
nécrosante a été observé chez un sujet traité avec VICTOZA®. (voir Pancréatite sous MISES EN
GARDE ET PRÉCAUTIONS).
Hypoglycémie : Il y a eu de rares épisodes d'hypoglycémie majeure pendant les études de phase
3a de longue durée (9 épisodes chez 8 sujets). Dans le cadre de l'essai clinique de phase 3b
comparant VICTOZA® + metformine à la sitagliptine + metformine (essai NN2211-1860), un
épisode d'hypoglycémie majeure a été signalé chez un patient traité avec VICTOZA®. Quand on
a ajouté l'insuline détémir à l'association VICTOZA® 1,8 mg + metformine, aucun épisode
d'hypoglycémie majeure (où le patient était incapable de traiter l'épisode lui-même) n'a été
observé.
Six de ces épisodes sont survenus quand le liraglutide était administré en association avec le
glimépiride. Quand le liraglutide s'employait avec une sulfonylurée ou une insuline, une
augmentation du taux d'hypoglycémie était observée (voir MISES EN GARDE ET
PRÉCAUTIONS – Système endocrinien et métabolisme – Hypoglycémie; POSOLOGIE ET
ADMINISTRATION – Considérations posologiques).
Au cours de l'essai 1572 (LEADMC 2), le taux d'hypoglycémie mineure était respectivement de
0,14, 0,03, 0,09, 0,13 et 1,23 épisode/sujet-année dans les groupes recevant 0,6 mg de liraglutide,
1,2 mg de liraglutide, 1,8 mg de liraglutide, un placebo et le glimépiride en plus de la
metformine; la proportion correspondante de sujets atteints était respectivement de 3,3 %, 0,8 %,
2,5 %, 2,5 % et 16,9 %. Le taux d'hypoglycémie nocturne mineure était respectivement de 0,00,
0,02, 0,00, 0,02 et 0,05 épisode/sujet-année.
Au cours de l'essai 1697 (LEADMC 5), le taux d'hypoglycémie mineure était respectivement de
1,16, 0,95 et 1,29 épisode/sujet-année dans les groupes recevant 1,8 mg de liraglutide, le placebo
et l'insuline glargine, en appoint avec le glimépiride et la metformine; la proportion
correspondante de sujets atteints était respectivement de 27,4 %, 16,7 % et 28,9 %. Des épisodes
d'hypoglycémie majeure sont survenus seulement dans le groupe du liraglutide, 6 épisodes ayant
été rapportés par 5 sujets. Le taux d'hypoglycémie majeure était respectivement de 0,06, 0,00 et
0,00 épisode/sujet-année et le taux d'hypoglycémie nocturne, de 0,16, 0,19 et 0,23 épisode/sujet-
année dans les groupes recevant 1,8 mg de liraglutide, le placebo et l'insuline glargine, chacun
en association avec le glimépiride et la metformine.
Au cours de l'essai 1860, le taux d'hypoglycémie mineure était respectivement de 0,18, 0,37 et
0,11 épisode/sujet-année dans les groupes recevant 1,2 mg de liraglutide, 1,8 mg de liraglutide et
la sitagliptine, chacun en association avec la metformine; la proportion correspondante de sujets
atteints était respectivement de 5,4 %, 5,0 % et 4,6 %. Le taux d'hypoglycémie quelconque et le
Monographie de VICTOZA® (liraglutide)
Page 21 sur 62
taux d'hypoglycémie mineure étaient significativement plus élevés dans le groupe traité avec
1,8 mg de liraglutide et la metformine que dans celui recevant la sitagliptine et la metformine.
Au cours de l'essai 1842, aucun épisode d'hypoglycémie majeure n'a été observé lors de l'ajout
de l'insuline au traitement par VICTOZA® à 1.8 mg et metformine. Le taux d'hypoglycémie
mineure (où le patient est capable de traiter l'épisode lui-même) pendant la phase principale de
26 semaines et la phase de prolongation de 26 semaines était peu élevé dans tous les groupes,
soit respectivement de 0,23, 0,03 et 0,12 épisode par année-patient dans le groupe recevant
l'insuline détémir, en plus de 1,8 mg de liraglutide et de la metformine, dans le groupe recevant
1,8 mg de liraglutide et la metformine et chez les sujets non randomisés recevant 1,8 mg de
liraglutide et la metformine. L'incidence d'épisodes d'hypoglycémie mineure a été
significativement plus élevée dans le groupe recevant l'insuline détémir, 1,8 mg de liraglutide et
de la metformine que dans le groupe recevant 1,8 mg de liraglutide et la metformine seulement
(p = 0,0011) quand on a exclu le cas aberrant d'un patient du groupe sous 1,8 mg de liraglutide et
metformine ayant des antécédents d'hypoglycémie fréquente
.
Effets indésirables gastro-intestinaux : Au cours des essais cliniques de longue durée réunis,
des effets indésirables gastro-intestinaux ont été observés chez 41 % des patients traités avec
VICTOZA®. Ces effets étaient liés à la dose de VICTOZA®. Des effets indésirables gastro-
intestinaux ont été observés chez 17 % des patients recevant l'un des comparateurs. Les nausées,
les vomissements, la diarrhée, la dyspepsie et la constipation sont survenus plus souvent chez les
patients traités avec VICTOZA®. Environ 13 % des patients traités avec VICTOZA® et 2 % de
ceux recevant l'un des comparateurs ont eu des nausées au cours des deux premières semaines de
traitement. La plupart des épisodes de nausée étaient d'une intensité légère ou modérée, qui a
diminué avec le temps (voir la figure 1)4 . Les effets indésirables gastro-intestinaux ont mené au
retrait de 5,0 % des patients traités avec VICTOZA® et de 0,5 % des patients prenant l'un des
comparateurs, le plus souvent au cours des 2-3 premiers mois des essais.
Au cours de l'essai NN2211-1860, le pourcentage des patients qui ont signalé avoir eu des
nausées au cours des deux premières semaines de traitement était de 16,3 %, 17,4 % et 2,7 %
dans les groupes recevant respectivement 1,2 mg de liraglutide, 1,8 mg de liraglutide et la
sitagliptine, chacun en association avec la metformine.
Au cours de l'essai NN2211-1842, le pourcentage des patients ayant signalé des nausées au
cours des 12 premières semaines de traitement était de 14,1 %, 18,9 % et 24,2 % respectivement,
dans le groupe recevant l'insuline détémir, 1,8 mg de liraglutide et de la metformine, dans le
groupe recevant 1,8 mg de liraglutide et la metformine, et chez les sujets non randomisés
recevant 1,8 mg de liraglutide et la metformine. Pendant la période de traitement subséquente de
52 semaines, 2,5 %, 1,9 % et 3,6 % des patients ont signalé des nausées dans le groupe sous
insuline détémir, 1,8 mg de liraglutide et metformine, dans le groupe sous 1,8 mg de liraglutide
et metformine, et et chez les sujets non randomisés recevant 1,8 mg de liraglutide et la
metformine, respectivement. Au total, 8,6 % (n = 85) des patients se sont retirés de l'étude en
raison des effets indésirables gastro-intestinaux.
Monographie de VICTOZA® (liraglutide)
Page 22 sur 62
Figure 1 : Proportion observée de patients nauséeux au cours de l'essai LEADMC 2. †††
p < 0,0001, ††
p < 0,01, †
p < 0,5 par rapport au placebo4.
Le taux de troubles gastro-intestinaux chez les patients traités avec VICTOZA® augmentait avec
l'âge, en particulier chez les patients prenant 1,8 mg de VICTOZA®. (Voir INDICATIONS ET
UTILISATION CLINIQUE – Gériatrie (> 65 ans); MISES EN GARDE ET PRÉCAUTIONS –
Populations particulières – Troubles gastro-intestinaux; POSOLOGIE ET ADMINISTRATION
– Considérations posologiques; MODE D'ACTION ET PHARMACOLOGIE CLINIQUE –
Pharmacodynamique – Vidange gastrique).
Les patients atteints d'insuffisance rénale légère ou modérée (clairance de la créatinine entre
60 et 90 mL/min et entre 30 et 59 mL/min, respectivement) peuvent présenter plus d'effets
gastro-intestinaux lorsqu'ils sont traités par le liraglutide.
Monographie de VICTOZA® (liraglutide)
Page 23 sur 62
Figure 2 : Taux des épisodes de troubles gastro-intestinaux selon le traitement et le groupe d'âge, dans la population
d'innocuité de l'ensemble des essais cliniques de longue durée
liraglutide 0.6 mg
liraglutide 1.2 mg
liraglutide 1.8 mg
comparateur actif
Immunogénicité : Au cours des essais cliniques réunis d'une durée d'au moins 26 semaines, de
50 à 70 % des patients traités avec VICTOZA® ont subi des analyses à la fin du traitement afin
de déceler la présence d'anticorps anti-liraglutide. Ces anticorps ont été observés chez 8,6 % des
patients. Le pourcentage réel de patients ayant des anticorps risque d'être supérieur à celui
estimé, étant donné que le dépistage n'a pas été effectué uniformément sur la totalité des patients
des essais cliniques. Des anticorps croisés anti-GLP-1 naturel ont été décelés chez 6,9 % des
patients traités avec VICTOZA® en monothérapie lors d'un essai clinique de 52 semaines et chez
4,8 % des patients traités avec VICTOZA® en association avec un autre traitement lors d'essais
cliniques de 26 semaines. L'effet neutralisant de ces anticorps sur le GLP-1 naturel n'a pas été
étudié; par conséquent, le potentiel clinique de neutralisation du GLP-1 naturel n'a pas été
évalué. Des anticorps ayant un effet neutralisant sur le liraglutide ont été décelés lors d'analyses
in vitro chez 2,3 % des patients traités avec VICTOZA® en monothérapie lors d'un essai clinique
de 52 semaines et chez 1 % des patients traités avec VICTOZA® en association lors d'essais
cliniques de 26 semaines.
La formation d'anticorps ne s'accompagnait pas d'une réduction de l'efficacité de VICTOZA® si
l'on compare le taux d'HbA1c moyen des patients séropositifs à celui des patients séronégatifs
pour des anticorps. Par contre, les trois patients pour lesquels le titre d'anticorps anti-liraglutide
était le plus élevé n'ont pas vu leur taux d'HbA1c diminuer pendant le traitement par
VICTOZA®.
Monographie de VICTOZA® (liraglutide)
Page 24 sur 62
Chez les patients n'ayant aucun anticorps anti-liraglutide, les effets indésirables les plus
fréquents étaient des troubles gastro-intestinaux (35,7 %), des infections et infestations (36,1 %)
ainsi que des troubles du système nerveux (13,6 %). Chez les patients ayant des anticorps anti-
liraglutide, les effets indésirables les plus fréquents étaient des infections et des infestations
(40 %), des troubles gastro-intestinaux (36,9 %) ainsi que des troubles des tissus
musculosquelettiques et conjonctifs (20,6 %). Deux patients ayant des anticorps anti-liraglutide
ont signalé quatre épisodes d'hypersensibilité, soit 33,6 épisodes pour 1000 sujets-années, alors
que dix patients sans anticorps anti-liraglutide en ont signalé dix, soit 5,5 épisodes pour
1000 sujets-années. Un patient ayant des anticorps anti-liraglutide a signalé de l'hypersensibilité
au traitement, soit 8,4 épisodes pour 1000 sujets-années, alors que quatre patients sans anticorps
anti-liraglutide en ont signalé cinq épisodes, soit 2,8 épisodes pour 1000 sujets-années.
Lors des essais cliniques sur VICTOZA®, des effets indésirables potentiellement liés à
l'immunogénicité, comme l'urticaire ou l'œdème de Quincke, ont été observés chez 0,8 % des
patients traités avec VICTOZA®, soit 12,2 épisodes pour 1000 sujets-années, ainsi que chez
0,4 % des patients traités avec l'un des comparateurs, soit 6,3 épisodes pour 1000 sujets-années.
Les patients ayant des anticorps anti-liraglutide n'étaient donc pas plus susceptibles de souffrir
d'effets indésirables liés à l'immunogénicité que ceux n'en ayant pas.
Réactions au point d'injection : Lors des essais cliniques comparatifs de longue durée, des
réactions au point d'injection ont été observées chez environ 2 % des patients traités avec
VICTOZA®. Ces réactions étaient le plus souvent des ecchymoses et des douleurs. Le taux de
réactions au point d'injection (nombre d'épisodes pour 1000 sujets-années) était respectivement
de 18,1, de 27,6 et de 37,6 chez les sujets recevant le liraglutide à la dose de 0,6 mg, 1,2 mg et
1,8 mg, comparativement à 34,0 et 14,9 chez les sujets recevant un placebo ou un comparateur
actif.
Lors d'un essai clinique comparant VICTOZA® plus la metformine à la sitagliptine plus la
metformine (essai NN2211-1860), des réactions au point d'injection ont été observées chez 3 %
des patients traités avec VICTOZA®. Ces réactions étaient le plus souvent des hématomes, des
ecchymoses et des douleurs. Le nombre de réactions au point d'injection était de 10 épisodes
signalés par 8 des 221 patients du groupe recevant 1,2 mg de liraglutide, et de 13 épisodes chez
7 des 218 patients du groupe recevant 1,8 mg de liraglutide. Comme prévu, aucune réaction au
point d'injection n'a été observée chez les sujets du groupe recevant le comparateur, qui était
administré par voie orale uniquement.
Moins de 0,2 % des patients traités avec VICTOZA® ont arrêté le traitement à cause des
réactions au point d'injection. Aucun d'entre eux n'était séropositif pour des anticorps anti-
liraglutide.
Effets indésirables graves peu fréquents et effets indésirables rares d'intérêt observés au
cours des essais cliniques de longue durée (≥ 0,1% et < 1%)
Monographie de VICTOZA® (liraglutide)
Page 25 sur 62
Troubles cardiaques : angine de poitrine, infarctus aigu du myocarde, infarctus du myocarde,
coronaropathie, fibrillation auriculaire, insuffisance cardiaque congestive et tachycardie
supraventriculaire.
Troubles de la vue : cataracte.
Troubles gastro-intestinaux : appendicite perforante, gastrite, hernie inguinale et pancréatite.
Infections et infestations : infection des voies respiratoires supérieures, bronchite, gastroentérite
et ostéomyélite.
Néoplasmes bénins, malins et non précisés (y compris kystes et polypes) : cancer papillaire
de la thyroïde, cancer de la prostate et cancer du sein.
Troubles des tissus musculosquelettiques et conjonctifs : protrusion discale et arthrose.
Troubles du système nerveux : accident vasculaire cérébral et syncope.
Blessure, empoisonnement et complications de l'administration : chute.
Troubles généraux et réactions au point d'injection : douleur thoracique.
Troubles du métabolisme et de la nutrition : hypoglycémie.
Troubles respiratoires, thoraciques et médiastinaux : embolie pulmonaire.
Effets indésirables observés depuis la commercialisation du médicament Les effets indésirables supplémentaires ci-dessous ont été signalés lors de l'utilisation de
VICTOZA® à la suite de son lancement sur le marché. Étant donné que ces effets sont signalés
volontairement parmi un nombre indéterminé de personnes, il est généralement impossible d'en
tirer des données fiables sur la fréquence ou d'établir une relation causale entre ces effets
indésirables et l'exposition au médicament.
déshydratation résultant des nausées et vomissements et de la diarrhée voir MISES EN
GARDE ET PRÉCAUTIONS dans la PARTIE I et la PARTIE III;
augmentation de la créatinine sérique, insuffisance rénale aiguë ou aggravation de
l'insuffisance rénale chronique, nécessitant parfois une hémodialyse voir MISES EN GARDE ET PRÉCAUTIONS dans la PARTIE I et la PARTIE III;
œdème de Quincke et réactions anaphylactiques voir CONTRE-INDICATIONS et MISES
EN GARDE ET PRÉCAUTIONS dans la PARTIE I et EFFETS SECONDAIRES GRAVES : FRÉQUENCE ET MESURES À PRENDRE dans la PARTIE III;
réactions allergiques : éruption et prurit;
pancréatite aiguë, pancréatite hémorragique ou nécrosante, parfois mortelle voir MISES EN
GARDE ET PRÉCAUTIONS dans la PARTIE I.
Ces effets indésirables ne modifient pas le profil d'innocuité de VICTOZA®.
INTERACTIONS MÉDICAMENTEUSES
Aucune interaction médicamenteuse cliniquement importante n'a été mise en évidence avec
VICTOZA®.
Interactions médicament-médicament
Monographie de VICTOZA® (liraglutide)
Page 26 sur 62
Évaluation in vitro des interactions médicament-médicament
VICTOZA® s'est révélée très peu susceptible de causer des interactions pharmacocinétiques
médicament-médicament, reliées au cytochrome P450 (CYP) ou à la fixation aux protéines
plasmatiques.
Évaluation in vivo des interactions médicament-médicament
Les interactions médicament-médicament ont été étudiées à l'aide d'acétaminophène, de
digoxine, de lisinopril, de griséofulvine et d'atorvastatine, qui présentent différents degrés de
solubilité et de perméabilité. En outre, des études ont été effectuées relativement à l'effet du
liraglutide sur l'absorption de l'éthinylestradiol et du lévonorgestrel administrés ensemble dans
un contraceptif oral.
Le léger retard de la vidange gastrique occasionné par le liraglutide n'a pas empêché l'absorption
des médicaments oraux à un degré cliniquement pertinent. Néanmoins, il faut faire preuve de
prudence quand un médicament oral est administré avec VICTOZA®.
Acétaminophène VICTOZA® n'a pas modifié l'exposition générale (ASC) à l'acétaminophène, administré à raison
d'une dose unique de 1000 mg. La Cmax d'acétaminophène a diminué de 31 % et le tmax médian a
accusé un retard allant jusqu'à 15 minutes.
Atorvastatine VICTOZA® n'a pas modifié l'exposition globale (ASC) à l'atorvastatine, administrée à raison
d'une dose unique de 40 mg. Après la prise de liraglutide, la Cmax d'atorvastatine a diminué de
38 % et le tmax médian a accusé un retard de 1 à 3 heures.
Griséofulvine
VICTOZA® n'a pas modifié l'exposition globale (ASC) à la griséofulvine, administrée à raison
d'une dose unique de 500 mg. La Cmax de la griséofulvine a augmenté de 37 %, tandis que le tmax
médian est resté le même.
Digoxine L'administration d'une dose unique de 1 mg de digoxine en association avec le liraglutide a
produit une réduction de l'ASC de la digoxine de 16 %, tandis que la Cmax a diminué de 31 %. La
médiane du temps nécessaire pour atteindre la Cmax de digoxine (Tmax) a été prolongée, passant
de 1 h à 1,5 h.
Lisinopril L'administration d'une dose unique de 20 mg de lisinopril en association avec le liraglutide a
entraîné une réduction de l'ASC du lisinopril de 15 %, tandis que la Cmax a diminué de 27 %. La
prise de liraglutide a retardé l'atteinte de la Cmax de lisinopril, le Tmax médian passant de 6 h à
8 h.
Monographie de VICTOZA® (liraglutide)
Page 27 sur 62
Contraceptifs oraux
VICTOZA® a fait baisser la Cmax d'éthinylestradiol et de lévonorgestrel de 12 et 13 %,
respectivement, après la prise d'une dose unique d'un contraceptif oral. La prise de liraglutide a
entraîné un retard de 1,5 heure du tmax pour les deux composés. Aucun effet significatif sur le
plan clinique en ce qui concerne l'exposition générale (ASC) à l'éthinylestradiol ou au
lévonorgestrel n'a été observé. Par conséquent, on s'attend à ce que l'effet contraceptif ne soit
pas modifié par l'administration concomitante de liraglutide.
Warfarine et autres dérivés de la coumarine
Aucune étude sur l'interaction avec ces substances n'a été effectuée. Une interaction
significative sur le plan clinique avec des substances actives peu solubles ou dont l'index
thérapeutique est étroit, comme la warfarine, ne peut être exclue. Au début du traitement avec le
liraglutide, il est recommandé de surveiller plus fréquemment le RNI (rapport normalisé
international) chez les patients qui prennent de la warfarine ou d'autres dérivés de la coumarine.
En association avec l'insuline
Aucune interaction pharmacocinétique n'a été observée entre VICTOZA® et l'insuline détémir
quand on a injecté séparément par voie sous-cutanée une seule dose d'insuline détémir
(0,5 unité/kg) et 1,8 mg de VICTOZA® (à l'état d'équilibre) chez des patients atteints du diabète
de type 2.
[Module 2.7.2 Summary of Clinical Pharmacology, Study NN2211-3673 (PK/PD
Study), Page 27]
Médicaments qui augmentent la fréquence cardiaque VICTOZA® augmente la fréquence cardiaque (voir Électrophysiologie cardiaque sous MODE
D'ACTION ET PHARMACOLOGIE CLINIQUE). L'effet sur la fréquence cardiaque de la
coadministration de VICTOZA® avec un autre médicament qui augmente la fréquence cardiaque
(comme un sympathomimétique) n'a pas été évalué dans le cadre d'études sur des interactions
médicament-médicament. La coadministration de VICTOZA® avec un tel médicament exige
donc la prudence.
Médicaments qui allongent l'intervalle PR VICTOZA® allonge l'intervalle PR (voir Électrophysiologie cardiaque sous MODE D'ACTION
ET PHARMACOLOGIE CLINIQUE). L'effet sur l'intervalle PR de la coadministration de
VICTOZA® avec un autre médicament qui allonge l'intervalle PR (comme un inhibiteur
calcique, un bêta-bloquant, un glucoside digitalique ou un inhibiteur de la protéase du VIH) n'a
pas été évalué dans le cadre d'études sur des interactions médicament-médicament. La
coadministration de VICTOZA® avec un tel médicament exige donc la prudence.
Interactions médicament-aliment
Il n'existe aucune interaction connue avec un aliment.
Interactions médicament-herbe médicinale Aucune interaction avec des produits à base d'herbes médicinales n'a été établie.
Monographie de VICTOZA® (liraglutide)
Page 28 sur 62
POSOLOGIE ET ADMINISTRATION
Considérations posologiques Pour tous les patients, VICTOZA® est administré une fois par jour, à n'importe quelle heure,
indépendamment des repas. Au début du traitement, VICTOZA® doit être administré à une dose
de 0,6 mg, une fois par jour, pendant au moins une semaine. Cette dose initiale permet de
diminuer l'apparition de symptômes de nature gastro-intestinale en début de traitement. Après
une semaine, la dose quotidienne de 0,6 mg doit être augmentée à 1,2 mg. Selon la réponse au
traitement et après au moins une semaine, la dose peut être augmentée à 1,8 mg, une fois par
jour, en vue d'obtenir un meilleur contrôle de la glycémie.
VICTOZA® peut être ajouté à un traitement existant par la metformine. Le traitement par la
metformine peut être poursuivi à la même dose, selon le jugement du médecin.
VICTOZA® peut être ajouté à un traitement par la metformine et une sulfonylurée. Durant les
essais cliniques, les médecins étaient invités à envisager de diminuer la dose de la sulfonylurée
pour réduire le risque d'hypoglycémie.
Si on utilise VICTOZA® en association avec une insuline, il faut les injecter séparément, jamais
mélangés. Il est acceptable d'injecter VICTOZA® et l'insuline dans la même région du corps,
mais les points d'injection ne doivent pas être adjacents.
Posologie recommandée et ajustement posologique Insuffisance rénale : Aucun ajustement posologique n'est nécessaire pour les patients atteints
d'insuffisance rénale légère ou modérée (clairance de la créatinine entre 60 et 90 mL/min et entre
30 et 59 mL/min, respectivement). Il n'y a pas ou à peu près pas d'expérience clinique sur
l'administration de VICTOZA® à des patients atteints d'insuffisance rénale grave
(< 30 mL/min), voire terminale; l'administration de VICTOZA® à ces patients n'est pas
recommandée (voir Populations particulières sous MISES EN GARDE ET PRÉCAUTIONS et
Populations particulières et états pathologiques sous MODE D'ACTION ET
PHARMACOLOGIE CLINIQUE).
Insuffisance hépatique : L'innocuité et l'efficacité de VICTOZA® n'ont pas été évaluées chez
les patients atteints d'insuffisance hépatique. L'administration de VICTOZA® à ces patients n'est
pas recommandée. (Voir Populations particulières sous MISES EN GARDE ET
PRÉCAUTIONS et Populations particulières et états pathologiques sous MODE D'ACTION ET
PHARMACOLOGIE CLINIQUE).
Gériatrie (> 65 ans) : Les essais cliniques de VICTOZA® ont regroupé 797 (20 %) patients âgés
de 65 ans ou plus et 113 (2,8 %) patients de 75 ans ou plus. Aucune différence globale
d'efficacité ou d'innocuité n'a été observée entre ces sujets et les sujets plus jeunes, mais une
plus grande sensibilité de certaines personnes âgées ne peut pas être exclue. (Voir Populations
Monographie de VICTOZA® (liraglutide)
Page 29 sur 62
particulières sous MISES EN GARDE ET PRÉCAUTIONS; EFFETS INDÉSIRABLES – Effets
indésirables du médicament observés au cours des essais cliniques – Effets indésirables gastro-
intestinaux; et Populations particulières et états pathologiques sous MODE D'ACTION ET
PHARMACOLOGIE CLINIQUE).
Pédiatrie (< 18 ans) : L'innocuité et l'efficacité de VICTOZA® n'ont pas été évaluées chez les
patients âgés de moins de 18 ans. VICTOZA® n'est pas indiqué chez ces patients.
Dose oubliée Si une dose de VICTOZA® est sautée, la dose du lendemain doit être prise comme d'habitude.
Ne pas prendre une dose supplémentaire ni augmenter la dose du lendemain pour compenser la
dose oubliée.
Administration VICTOZA® est administré une fois par jour, à n'importe quelle heure, indépendamment des
repas. VICTOZA® peut être injecté par voie sous-cutanée dans l'abdomen, la cuisse ou le haut du
bras. Le point d'injection et le moment de l'administration peuvent être modifiés au besoin sans
ajuster la dose.
SURDOSAGE
Pour traiter une surdose présumée, communiquez avec le centre antipoison de votre région.
Des cas de surdoses allant jusqu'à 40 fois la dose d'entretien recommandée (72 mg) ont été
signalés dans le cadre d'essais cliniques et après la commercialisation. On a signalé un cas de
surdose (18 mg par jour) administrée pendant 7 mois : cette dose était dix fois plus élevée que
celle recommandée. Les patients se sont rétablis sans complication. Les patients ont signalé des
nausées, des vomissements et une diarrhée graves. Aucun patient n'a signalé une hypoglycémie
grave.
En cas de surdose, un traitement de soutien approprié, adapté aux signes cliniques et aux
symptômes du patient doit être instauré.
MODE D'ACTION ET PHARMACOLOGIE CLINIQUE
Mode d'action
VICTOZA® (liraglutide) est un agoniste acylé du récepteur du GLP-1 (
glucagon-like peptide-1)
humain, dont la séquence d'acides aminés présente 97 % d'homologie avec le GLP-1 (7-37)
humain endogène. Le GLP-1 (7-37) représente moins de 20 % des GLP-1 endogènes présents
dans la circulation. Comme le GLP-1 (7-37), le liraglutide active le récepteur du GLP-1, un
récepteur membranaire couplé à l'adénylcyclase par la protéine G stimulatrice (Gs) présente dans
les cellules bêta du pancréas. Le liraglutide augmente la formation d'AMP cyclique (AMPc)
dans les cellules, stimulant ainsi la sécrétion d'insuline en présence d'une glycémie élevée. La
sécrétion d'insuline est ralentie lorsque la glycémie diminue et qu'elle se rapproche de
Monographie de VICTOZA® (liraglutide)
Page 30 sur 62
l'euglycémie. De plus, le liraglutide réduit la sécrétion de glucagon de manière glucodépendante.
Par ailleurs, le mécanisme hypoglycémiant entraîne un léger retard de la vidange gastrique.
Le GLP-1 (7-37) a une demi-vie de 1,5 à 2 minutes en raison de sa dégradation par des enzymes
endogènes ubiquistes : la dipeptidyle peptidase IV (DPP-IV) et l'endopeptidase neutre (NEP).
Contrairement au GLP-1 naturel, le liraglutide présente une bonne stabilité face à la dégradation
métabolique par ces deux peptidases et a une demi-vie plasmatique de 13 heures après son
injection sous-cutanée. Le profil pharmacocinétique du liraglutide, qui permet une administration
quotidienne unique, résulte d'une auto-association qui retarde l'absorption, de sa liaison aux
protéines plasmatiques et de sa stabilité accrue face à la dégradation métabolique par la DPP-IV
et la NEP.
Pharmacodynamique
VICTOZA® a une durée d'action de 24 heures et améliore le contrôle de la glycémie à long
terme en diminuant la glycémie à jeun et la glycémie postprandiale chez les patients atteints de
diabète de type 2. Une hyperglycémie mal contrôlée est associée à un risque accru de
complications du diabète, notamment de troubles cardiovasculaires et de néphropathie,
rétinopathie et neuropathie diabétiques1.
Des doses de 1,8 mg et 1,2 mg de VICTOZA® ont permis de faire diminuer la glycémie à jeun
moyenne de 3,90 mmol/L et de 3,33 mmol/L, respectivement, en comparaison avec un placebo
(figure 3). Deux heures après un repas normal, les différences de glycémie postprandiale
moyenne entre le placebo et les deux doses de VICTOZA® étaient de 6,02 mmol/L et de
5,63 mmol/L. De plus, les doses de 1,8 mg et de 1,2 mg de VICTOZA® ont fait baisser la
glycémie postprandiale différentielle (définie comme étant la différence entre les valeurs de la
glycémie 90 minutes après le repas et celles immédiatement après le repas pour les trois repas)
de 1,1 mmol/L et 1,08 mmol/L, en moyenne, respectivement.
Figure 3 : Glycémie postprandiale moyenne absolue (gauche) et différentielle (droite) chez des patients atteints de diabète de
type 2 traités avec 1,8 mg de liraglutide ou un placebo dans le cadre d'un essai croisé (n = 18) [essai 1698]
Sécrétion glucodépendante d'insuline : VICTOZA® a stimulé la sécrétion d'insuline en rapport
avec l'augmentation de la glycémie. À la suite d'une perfusion de glucose par paliers et de
l'administration d'une dose unique de liraglutide, le taux de sécrétion d'insuline a augmenté chez
Monographie de VICTOZA® (liraglutide)
Page 31 sur 62
des patients atteints de diabète de type 2 jusqu'à atteindre un taux comparable à celui observé chez des sujets en bonne santé (figure 4).
Figure 4 : Taux d'insulinosécrétion moyen en fonction de la glycémie après une perfusion de glucose par paliers et
l'administration d'une dose unique de 7,5 µg/kg ( 0,66 mg) de liraglutide ou de placebo à des sujets atteints de diabète de type 2
(n = 10) et des sujets en bonne santé non traités (n = 10) [essai 2063]
Sécrétion de glucagon : VICTOZA® a fait diminuer la glycémie en stimulant la sécrétion
d'insuline et en réduisant la sécrétion de glucagon. Une dose unique d'environ 0,7 mg de
VICTOZA® n'a pas altéré la sécrétion de glucagon en réponse à une glycémie faible. De plus, on
a observé une plus faible sécrétion de glucose endogène avec VICTOZA® à cause de la sécrétion
accrue d'insuline et de la sécrétion réduite de glucagon.
Vidange gastrique : VICTOZA® ralentit la vidange gastrique et, par conséquent, l'apparition du
glucose postprandial dans la circulation.
Électrophysiologie cardiaque: Un essai comparatif croisé avec placebo à double insu, mené en
deux périodes avec répartition aléatoire a été effectué auprès de 51 volontaires en bonne santé
âgés de 18 à 44 ans (25 hommes et 26 femmes). Après la répartition aléatoire, les sujets du
groupe du liraglutide ont reçu par voie sous-cutanée 0,6 mg de liraglutide une fois par jour
pendant la première semaine, 1,2 mg de liraglutide une fois par jour pendant la deuxième
semaine et 1,8 mg de liraglutide une fois par jour pendant la troisième semaine, selon un schéma
d'ajustement croissant. Immédiatement après la septième et dernière dose de la deuxième et de la
troisième semaine, soit 1,2 mg et 1,8 mg de liraglutide respectivement, les sujets ont passé une
série d'ECG pendant 24 heures. Les sujets du groupe du placebo ont suivi le même calendrier de
traitement et d'examens, sauf qu'ils recevaient des injections sous-cutanées de placebo.
Fréquence cardiaque : La dose de 1,2 mg de liraglutide au 14e jour de traitement et celle de
1,8 mg de liraglutide au 21e jour de traitement étaient associées à une augmentation
statistiquement significative de la fréquence cardiaque à tous les moments de la journée. La
proportion de sujets présentant une fréquence cardiaque supérieure à 90 BPM était de 20 % dans
le groupe traité avec 1,2 mg de liraglutide et de 8 % dans celui recevant le placebo. Cette
Monographie de VICTOZA® (liraglutide)
Page 32 sur 62
proportion était de 23,5 % dans le groupe recevant 1,8 mg de liraglutide et de 3,9 % dans celui recevant le placebo. Figure 5
Légende : Delta : La différence entre la FC mesurée et la FC initiale pour chaque patient. LCL : limite inférieure de l'intervalle de confiance, UCL : limite supérieure de l'intervalle de confiance
Intervalle PR : La dose de 1,2 mg de liraglutide au 14e jour de traitement entraînait une prolongation statistiquement significative de l'intervalle PR à tous les moments de la journée. La dose de 1,8 mg de liraglutide au 21e jour de traitement entraînait une prolongation statistiquement significative de l'intervalle PR à 10 moments de la journée sur 12, à la suite de l'administration de la dose. Pour la dose de 1,2 mg, la moyenne maximale de l'allongement ajustée sur le placebo et les valeurs initiales était de 10 ms (IC à 90 % : 6,9 et 13,1). Pour la dose de 1,8 mg, cette moyenne était de 9,0 ms (IC à 90 % : 6,1 et 12,0). En cours de traitement, l'intervalle PR a dépassé 200 ms chez 4 % des sujets recevant le liraglutide et chez 2 % des sujets recevant le placebo. La proportion de sujets ayant un intervalle PR supérieur à 200 ms au début de l'essai et dont la fréquence ou l'ampleur ont augmenté en cours de traitement était de 6 % dans le groupe recevant le liraglutide et de 2 % dans le groupe recevant le placebo.
Légende : Delta : La différence entre le PR mesuré et le PR initial pour chaque patient. LCL : limite inférieure de l'intervalle de confiance, UCL : limite supérieure de l'intervalle de confiance
Monographie de VICTOZA® (liraglutide)
Page 33 sur 62
Intervalle QT : Les doses de 1,2 mg et de 1,8 mg de liraglutide étaient associées à une diminution statistiquement significative de l'intervalle QTc à la plupart des moments de la journée suivant l'administration de la dose. La portée clinique d'une telle diminution de l'intervalle QTc sous liraglutide n'est pas connue. Figure 7
Légende : Delta : La différence entre le QTc mesuré et le QTc initial pour chaque patient.
LCL : limite inférieure de l'intervalle de confiance, UCL : limite supérieure de l'intervalle de confiance
En association avec l'insuline
Aucune interaction pharmacodynamique n'a été observée entre VICTOZA® et l'insuline détémir
lors de l'administration d'une seule dose d'insuline détémir (0,5 unité/kg) et de 1,8 mg de
VICTOZA® à l'état d'équilibre chez des patients atteints du diabète de type 2.
Pharmacocinétique Absorption : L'absorption de VICTOZA® administré par injection sous-cutanée est lente,
puisque la concentration met de 8 à 12 heures pour atteindre son maximum. La concentration
maximale estimée de liraglutide était de 9,4 nmol/L pour une dose unique de 0,6 mg de
liraglutide administrée par injection sous-cutanée. Pour une dose de 1,8 mg, la concentration
moyenne de liraglutide à l'état d'équilibre (ASCτ/24) était environ 34 nmol/L. L'exposition à
VICTOZA® (ASC) a augmenté de manière presque linéaire avec la dose (µg/kg) et présentait
une augmentation due à une accumulation entre le 1er et le 11e jour. Le coefficient de variation
interindividuelle de l'ASC du liraglutide s'élevait à 11 % après l'administration d'une dose
unique. VICTOZA® peut être administré par injection sous-cutanée dans l'abdomen, la cuisse ou
le haut du bras.
Après l'injection sous-cutanée, la biodisponibilité absolue de VICTOZA® est d'environ 55 %.
Distribution : Le volume de distribution apparent après une injection sous-cutanée se situe entre
11 et 17 L. Le volume de distribution moyen après une injection intraveineuse de VICTOZA® est
de 0,07 L/kg. VICTOZA® se lie de manière considérable aux protéines plasmatiques (
> 98 %).
Monographie de VICTOZA® (liraglutide)
Page 34 sur 62
Métabolisme : Dans les 24 heures suivant l'administration d'une dose unique de [3H]-liraglutide
à des sujets en bonne santé, le principal composant se retrouvant dans le plasma était le
liraglutide intact. Deux métabolites mineurs ont été décelés dans le plasma (< 9 % et < 5 % de
l'exposition totale du plasma à la radioactivité). VICTOZA® est métabolisé dans l'organisme de
la même manière que les grosses protéines, sans qu'un organe particulier serve de voie majeure
d'élimination.
Élimination : Après l'administration d'une dose de [1H]-liraglutide, l'urine et les fèces ne
contenaient pas de liraglutide intact. Seule une faible partie de la radioactivité administrée a été
excrétée sous forme de métabolites du liraglutide dans l'urine et les fèces, soit respectivement
6 % et 5 %. La radioactivité présente dans l'urine et les fèces a été excrétée en majeure partie
dans les six à huit premiers jours, et était composée de trois métabolites mineurs.
Après l'injection sous-cutanée d'une dose unique de VICTOZA®, la clairance moyenne est
d'environ 1,2 L/h et la demi-vie d'élimination est d'environ 13 heures.
Populations particulières et états pathologiques Pédiatrie (< 18 ans) : Aucun essai sur VICTOZA® n'a été mené auprès de patients âgés de
moins de 18 ans.
Gériatrie (> 65 ans) : L'exposition à VICTOZA® (ASC) ne dépend pas de l'âge (voir
POSOLOGIE ET ADMINISTRATION et MODE D'ACTION ET PHARMACOLOGIE
CLINIQUE).
Sexe : Une fois le poids corporel pris en compte, l'ASC(0-t), la Cmax, la tmax, l'ASC
(0-∞), la Cl/F, le Vz/F et le t½ observés après l'administration d'une dose unique de liraglutide
semblaient être comparables chez les sujets de sexe masculin et féminin. Une étude
pharmacocinétique menée auprès de sujets en bonne santé a montré que le sexe des sujets n'a
aucune incidence clinique sur la pharmacocinétique de VICTOZA®.
Race : Selon les résultats d'une analyse de données pharmacocinétiques sur une population
composée de sujets de races blanche, noire, asiatique et hispanique, la race ne semble avoir
aucun effet cliniquement pertinent sur la pharmacocinétique de VICTOZA®.
Insuffisance hépatique : Chez les sujets présentant une insuffisance hépatique à des degrés
variables, l'exposition à VICTOZA® était diminuée. Après l'administration d'une dose unique de
VICTOZA®, l'ASC chez des sujets présentant une insuffisance hépatique légère (score de 5 à 6
sur l'échelle de Child Pugh), modérée ou grave (score > 9 sur l'échelle de Child Pugh) était en
moyenne diminuée de 23 %, 13 % et 44 % respectivement, par comparaison avec celle des sujets
en bonne santé.
Monographie de VICTOZA® (liraglutide)
Page 35 sur 62
Insuffisance rénale : Chez les sujets présentant une insuffisance rénale à des degrés variables,
l'exposition à VICTOZA® était diminuée. Après l'administration d'une dose unique de
VICTOZA®, l'ASC chez des sujets présentant une insuffisance rénale légère (CLcr entre 50 et
80 mL/min), modérée (CLcr entre 30 et 50 mL/min), grave (CLcr inférieure à 30 mL/min) ou au
stade terminal (dialyse nécessaire) était en moyenne diminuée de 33 %, 14 %, 27 % et 26 %
respectivement, par comparaison avec celle des sujets en bonne santé.
Obésité : D'après une analyse de la covariance, le poids a une incidence importante sur la
pharmacocinétique de VICTOZA®. Plus le poids initial est élevé, plus l'exposition à VICTOZA®
diminue. Cependant, au cours des essais cliniques, des doses quotidiennes de 1,2 mg et 1,8 mg
de VICTOZA® ont permis d'obtenir une exposition générale adéquate chez les sujets dont le
poids était compris entre 40 et 160 kg. VICTOZA® n'a pas été étudié chez des patients pesant
plus de 160 kg.
ENTREPOSAGE ET STABILITÉ
VICTOZA® doit être conservé au réfrigérateur (entre 2 et 8 ºC). Ne pas le mettre juste à côté de
l'élément réfrigérant ni dans le congélateur. Ne pas congeler VICTOZA® et ne pas l'utiliser s'il a
gelé.
Après la première utilisation, il est possible de conserver un stylo VICTOZA® durant 30 jours à
température ambiante (sans dépasser 30 ºC) ou au réfrigérateur (entre 2 et 8 ºC).
INSTRUCTIONS PARTICULIÈRES DE MANIPULATION
Quand le stylo VICTOZA® n'est pas en train d'être utilisé, le capuchon du stylo doit être en
place pour protéger le médicament de la lumière. VICTOZA® doit être protégé de la chaleur
excessive et de la lumière du soleil. Après chaque injection, il faut absolument retirer l'aiguille
avant de ranger le stylo VICTOZA® afin de prévenir toute contamination, infection ou fuite, et
de garantir l'exactitude de la dose injectée.
Chaque stylo VICTOZA® doit être utilisé par un seul patient. Le stylo VICTOZA® ne doit
jamais être partagé entre les patients, même si l'aiguille a été changée.
FORMES POSOLOGIQUES, COMPOSITION ET CONDITIONNEMENT
VICTOZA® est offert sous forme de stylo prérempli jetable, qui comprend un injecteur et une cartouche de 3 mL. VICTOZA® contient les ingrédients non médicinaux suivants : phosphate disodique dihydraté, propylèneglycol, phénol et eau pour injection. La cartouche, faite de verre de type 1, comprend un piston en bromobutyle et est fermée par un bouchon en bromobutyle/polyisoprène. L'injecteur est fait de polyoléfine et de polyacétal.
Monographie de VICTOZA® (liraglutide)
Page 36 sur 62
Incinérées, ces matières se transforment uniquement en déchets non toxiques (dioxyde de
carbone et eau).
Le stylo VICTOZA® multidose permet d'injecter 30 doses de 0,6 mg, 15 doses de 1,2 mg ou
10 doses de 1,8 mg.
Présentations
Stylo VICTOZA® multidose (doses de 0,6 mg, 1,2 mg ou 1,8 mg) : 1 stylo (réserve de 10 jours
en tout), 2 stylos (réserve de 20 jours en tout) ou 3 stylos (réserve de 30 jours en tout).
Monographie de VICTOZA® (liraglutide)
Page 37 sur 62
PARTIE II : RENSEIGNEMENTS SCIENTIFIQUES
RENSEIGNEMENTS PHARMACEUTIQUES
Substance pharmaceutique
Formule moléculaire et masse moléculaire :
Formule développée :
Propriétés physicochimiques : Un mL contient 6 mg de liraglutide (produit par la technologie d'ADN recombinant à l'aide de
Saccharomyces cerevisiae). Chaque stylo prérempli contient 3 mL équivalant à 18 mg de liraglutide anhydre sans sel, un analogue du GLP-1 humain.
Caractéristiques du produit VICTOZA® (liraglutide) est une solution transparente et incolore.
ESSAIS CLINIQUES
Données démographiques et plan des essais
L'efficacité et l'innocuité de Victoza® ont été évaluées dans le cadre de quatre essais cliniques
comparatifs à double insu et à répartition aléatoire, soit l'essai 1572 (LEADMC 2), l'essai 1697
(LEADMC 5), l'essai 1860 et l'essai 1842.
Monographie de VICTOZA® (liraglutide)
Page 38 sur 62
Tableau 4 : Résumé des données démographiques initiales et plan des essais 1572, 1697, 1860 et 1842
Plan de l'essai
Posologie, voie d'administration et durée
(n = nombre)
l'étude
Essai comparatif
VICTOZA® (0,6 mg une fois par jour) +
multicentrique, à répartition
metformine (1500 à 2000 mg/jour)
aléatoire, à double insu et à
double placebo, avec un groupe
VICTOZA® (1,2 mg une fois par jour) +
metformine (1500 à 2000 mg/jour)
VICTOZA® (1,8 mg une fois par jour) + metformine (1500 à 2000 mg/jour) ou Placebo + metformine (1500 à 2000 mg/jour) ou Glimépiride (4 mg/jour) + metformine (1500 à 2000 mg/jour) VICTOZA® a été administré par voie sous-cutanée tandis que la metformine et le glimépiride ont été administrés par voie orale, une fois par jour, pendant 26 semaines
Essai comparatif multicentrique
VICTOZA® (1,8 mg une fois par jour) +
avec placebo, à répartition
metformine (2000 mg/jour) + glimépiride (2
aléatoire et à double insu, avec
un groupe témoin traité sans
insu par insuline glargine avec
Placebo + metformine (2000 mg/jour) +
cible prédéterminée
glimépiride (2 à 4 mg/jour) ou Insuline glargine + metformine (2000 mg/jour) + glimépiride (2 à 4 mg/jour) VICTOZA® et l'insuline glargine ont été administrés par voie sous-cutanée tandis que la metformine et le glimépiride ont été administrés par voie orale, une fois par jour, pendant 26 semaines
Essai multicentrique à
VICTOZA® (1,2 mg une fois par jour) +
répartition aléatoire, ouvert,
metformine (≥ 1500 mg/jour)
avec comparateur actif, à trois
groupes parallèles, d'une durée
VICTOZA® (1,8 mg une fois par jour) +
de 26 semaines, avec une
metformine (≥ 1500 mg/jour)
prolongation de 52 semaines
ou Sitagliptine + metformine (≥ 1500 mg/jour) VICTOZA® a été administré par voie sous-cutanée tandis que la sitagliptine et la metformine ont été administrées par voie orale, une fois par jour, pendant 26 semaines
Essai multicentrique et
VICTOZA® (1,8 mg une fois par jour) +
multinational à répartition
aléatoire, ouvert, à groupes
parallèles, d'une durée de
Victoza® 1,8 mg + Levemir® (insuline
26 semaines, avec une
détémir )+ metformine
prolongation de 26 semaines
ou Victoza® 1,8 mg + metformine sans randomisation
Monographie de VICTOZA® (liraglutide)
Page 39 sur 62
* Patients répartis aléatoirement et exposés
Dans l'essai LEADMC 2, la plupart des sujets (87 %) étaient de race blanche et 9 % étaient
classés comme Asiatiques ou Insulaires du Pacifique. Les sujets étaient atteints de diabète depuis
7,4 ans en moyenne (plage de 4 mois à 41 ans). Avant de participer à l'essai, 36 % des sujets
avaient été traités par un seul agent antidiabétique oral tandis que 64 % des sujets avaient été
traités par deux ou plusieurs antidiabétiques oraux.
Dans l'essai LEADMC 5, la plupart des sujets (75 %) étaient de race blanche et 16 % étaient
classés comme Asiatiques ou Insulaires du Pacifique. Les sujets étaient atteints de diabète depuis
9 ans en moyenne (plage de 5 mois à 44 ans). Avant de participer à l'essai, 6 % des sujets avaient
été traités par un seul agent antidiabétique oral tandis que 84 % des sujets avaient été traités par
deux ou plusieurs antidiabétiques oraux.
Pour l'essai 1860, le poids moyen des sujets était de 93,8 kg et leur IMC moyen était de
32,8 kg/m2. Ils étaient atteints de diabète depuis 6,2 ans en moyenne et leur HbA1c moyenne
initiale était de 8,5 %. La majorité des sujets (86,6 %) étaient de race blanche, et 7,2 % étaient de
race noire ou afro-américains. Environ 16 % étaient hispaniques ou d'origine latine5.
Traitement d'association avec la metformine (LEADMC 2)
Dans le cadre d'une étude d'une durée de 26 semaines, 1091 patients atteints de diabète de type 2
et ayant reçu différents antidiabétiques oraux pendant au moins 3 mois ont été répartis de façon
aléatoire, dans le rapport 2:2:2:1:2, pour recevoir 1,8 mg de VICTOZA®, 1,2 mg de VICTOZA®,
0,6 mg de VICTOZA®, un placebo ou du glimépiride, en tant que traitement d'appoint à la
metformine. Au moment de la répartition aléatoire, les sujets ont été divisés en fonction de leur
traitement antidiabétique oral antérieur (monothérapie ou association). La répartition aléatoire a
eu lieu après une période de 3 semaines d'ajustement forcé de la dose de metformine suivie
d'une période d'entretien de 3 semaines sous metformine. Au cours de la période d'ajustement,
la dose de metformine a été augmentée à 2000 mg. Après répartition aléatoire, une période
d'ajustement de 2 semaines a commencé, suivie d'une période de traitement d'entretien de
24 semaines avec des doses fixes de VICTOZA® et de glimépiride (4 mg). La dose de
glimépiride utilisée dans le cadre de l'étude était inférieure à la dose maximale de glimépiride
approuvée au Canada (8 mg), mais était égale à la dose maximale approuvée dans certains autres
pays participants. Au cours de l'essai, les doses de VICTOZA® et de glimépiride étaient fixes,
tandis que la dose de metformine devait être maintenue tout au long de l'étude, si possible.
Toutefois, la dose pouvait être réduite à un minimum de 1500 mg et de nouveau augmentée à
2000 mg, à la discrétion de l'investigateur2.
Le pourcentage de patients qui se sont retirés de l'étude en raison d'un traitement inefficace était
de 5,4 % dans le groupe de traitement par VICTOZA® (1,8 mg)
et metformine et de 3,7 % dans
le groupe de traitement par glimépiride
et metformine. Le traitement avec des doses de 1,8 mg et
1,2 mg (mais non avec la dose de 0,6 mg) de VICTOZA® en association avec la metformine a
Monographie de VICTOZA® (liraglutide)
Page 40 sur 62
entraîné des réductions moyennes de l'HbA1c qui n'étaient pas inférieures au résultat obtenu avec le traitement par glimépiride en association avec la metformine (tableau 5)2.
Monographie de VICTOZA® (liraglutide)
Page 41 sur 62
Tableau 5 : Résultats d'un essai sur VICTOZA® (liraglutide) en association avec la metformine, d'une durée
de 26 semainesa
Victoza®
Victoza®
Placebo +
metformine
metformine
metformine
metformine
Population en intention de traiter (n)
HbA1C (%) [moyenne]
Changement par rapport à la valeur initiale (moyenne ajustée)
Différence par rapport au groupe traité par glimépiride +
metformine (moyenne ajustée)
Intervalle de confiance à 95 %
Patients (%) ayant atteint un taux d'A1c
< 7 %
Glycémie à jeun (mmol/L) (moyenne)
Changement par rapport à la valeur initiale (moyenne ajustée)
Différence par rapport au groupe traité par glimépiride +
metformine (moyenne ajustée)
Poids corporel (kg) (moyen)
Changement par rapport à la valeur initiale (moyenne ajustée)
Différence par rapport au groupe traité par glimépiride +
metformine (moyenne ajustée)
Intervalle de confiance à 95 %a Population en intention de traiter avec le report des dernières observations b Moyenne, par la méthode des moindres carrés, ajustée sur les valeurs initiales ** Valeur
p < 0,0001
Traitement d'association avec la metformine – essai 1860 Dans le cadre d'une étude d'une durée de 26 semaines, 665 patients dont le diabète de type 2
n'était pas contrôlé adéquatement par la metformine seule ont été répartis de façon aléatoire,
dans le rapport 1:1:1, pour recevoir une dose quotidienne de 1,2 mg de liraglutide, de 1,8 mg de
liraglutide ou de 100 mg de sitagliptine en plus de la dose stable de metformine qu'ils prenaient
déjà avant l'étude ( 1500 mg). Vingt-six semaines après la répartition aléatoire, on a offert à
tous les sujets qui avaient terminé l'essai de participer à la prolongation. Parmi ceux-ci, 89,7 %
des patients ont accepté de poursuivre le traitement durant 52 semaines supplémentaires.
Après répartition aléatoire, les patients recevant 1,2 ou 1,8 mg de VICTOZA® ont augmenté
graduellement leur dose par paliers hebdomadaires de 0,6 mg jusqu'à ce qu'ils reçoivent une
dose de 1,2 mg ou 1,8 mg par jour. Les doses de VICTOZA® et de metformine étaient fixes
durant l'essai.
Le pourcentage de patients qui se sont retirés de l'étude après 52 semaines de traitement parce
qu'il était inefficace était de 2,7 % dans le groupe sous 1,2 mg de VICTOZA® et metformine, de
1,4 % dans le groupe sous 1,8 mg de VICTOZA® et metformine, et de 5,0 % dans le groupe sous
Monographie de VICTOZA® (liraglutide)
Page 42 sur 62
sitagliptine et metformine. Le traitement par 1,2 mg ou 1,8 mg de VICTOZA® en association
avec la metformine a entraîné une réduction moyenne statistiquement significative de l'HbA1c
par rapport au traitement par sitagliptine et metformine à la 26e semaine (voir tableau 6)5.
Tableau 6 : Résultats de l'essai no 1860 de 26 semaines comparant Victoza® à la sitagliptine (les deux en association avec
la metformine)
Victoza® 1,2 mg
Victoza® 1,8 mg
Sitagliptine +
+ metformine
+ metformine
metformine
Population analysée totale (n)
HbA1c (%) [moyenne]
Valeur initiale
Changement par rapport à la valeur initiale (moyenne ajustée)b
Différence par rapport au groupe traité par sitagliptine +
metformine (moyenne ajustée)
Intervalle de confiance à 95 %
Patients (%) ayant atteint un taux d'A1c < 7 %
GJ (mmol/L) (moyenne)
Valeur initiale
Changement par rapport à la valeur initiale (moyenne ajustée)b
Poids corporel (kg) (moyen)
Valeur initiale
Changement par rapport à la valeur initiale (moyenne ajustée)b
a Population en intention de traiter avec le report des dernières observations b Moyenne, par la méthode des moindres carrés, ajustée sur les valeurs initiales ** Valeur
p < 0,0001 Une évaluation de la supériorité statistique a été effectuée seulement après la démonstration que le traitement avec des doses de 1,2 mg et 1,8 mg de VICTOZA® en association avec la metformine n'était pas inférieur au traitement par la sitagliptine en association avec la metformine. Après 12 mois de traitement, les réductions du taux d'HbA1c qui avaient été observées après les six premiers mois avec les deux doses de liraglutide en association avec la metformine persistaient toujours. Les variations moyennes estimées du taux d'HbA1c après 52 semaines de traitement étaient de 1,29 % et 1,51 % dans les groupes sous liraglutide et metformine (1,2 mg et 1,8 mg) et de 0,88 % dans le groupe sous sitagliptine et metformine. La proportion estimée des sujets qui atteignaient l'objectif de l'ADA, c'est-à-dire un taux d'HbA1c inférieur à 7 %, à la 52e semaine, était de 50,3 % avec 1,2 mg de liraglutide et la metformine, de 63,3 % avec 1,8 mg
de liraglutide et la metformine, et de 27,1 % avec la sitagliptine et la metformine5.
Monographie de VICTOZA® (liraglutide)
Page 43 sur 62
Traitement d'association avec la metformine et une sulfonylurée (LEADMC 5)
Dans le cadre d'une étude d'une durée de 26 semaines, 581 patients atteints de diabète de type
2 et ayant reçu différents antidiabétiques oraux pendant au moins 3 mois ont été répartis de façon
aléatoire pour recevoir 1,8 mg de VICTOZA®, un placebo ou de l'insuline glargine, en tant que
traitement d'appoint à la metformine et au glimépiride. La répartition aléatoire a eu lieu après
une phase de préinclusion de 6 semaines consistant en 3 semaines d'ajustement forcé de la dose
de metformine et de glimépiride, suivie d'une période d'entretien de 3 autres semaines. Au cours
de la période d'ajustement, les doses de metformine et de glimépiride ont été augmentées à
2000 mg et à 4 mg, respectivement. La dose de glimépiride administrée dans le cadre de l'étude
était inférieure à la dose maximale de glimépiride approuvée au Canada (8 mg), mais était égale
à la dose maximale approuvée dans certains autres pays participants et se situait dans les limites
de la dose d'entretien habituelle de 1 à 4 mg. Après répartition aléatoire, les patients recevant
1,8 mg de VICTOZA® ont subi une période d'ajustement de 2 semaines avec VICTOZA®. Au
cours de l'essai, les doses de VICTOZA® et de metformine étaient fixes, tandis que la dose de
glimépiride pouvait être réduite à 3 ou 2 mg/jour. Les patients ajustaient la dose d'insuline
glargine deux fois par semaine pendant les 8 premières semaines de traitement en se basant sur
l'auto-mesure de leur glycémie à jeun le jour de l'ajustement. Après 8 semaines, la fréquence de
l'ajustement de l'insuline glargine était laissée à la discrétion de l'investigateur, mais, au
minimum, la dose d'insuline glargine devait être modifiée si nécessaire, aux semaines 12 et 183.
Seulement 20 % des patients traités par insuline glargine ont atteint la cible prédéterminée de
glycémie à jeun (< 5,5 mmol/L); par conséquent, l'ajustement optimal de la dose d'insuline
glargine n'a pas été atteint chez la plupart des patients. L'algorithme d'ajustement utilisé était
celui de l'étude AT.LANTUS (voir RÉFÉRENCES).
Le pourcentage de patients qui se sont retirés de l'étude en raison d'un traitement inefficace était de 0,9 % dans le groupe traité par VICTOZA® (1,8 mg), glimépiride et metformine, de 11,3 % dans le groupe traité par placebo, glimépiride et metformine, et de 0,4 % dans le groupe traité par insuline glargine, glimépiride et metformine. Le traitement par VICTOZA® (1,8 mg) en association avec le glimépiride et la metformine a entraîné une réduction moyenne statistiquement significative de l'HbA1c par rapport au traitement par placebo en association avec le glimépiride et la metformine (voir tableau 7)3.
Tableau 7 : Résultats d'un essai d'une durée de 26 semaines portant sur VICTOZA® (liraglutide) en
association avec la metformine et une sulfonyluréea
Victoza® (1,8 mg) +
Placebo +
Insuline glargine +
metformine +
metformine +
metformine +
Population en intention de traiter (n)
HbA1c (%) (moyenne)
Changement par rapport à la valeur initiale
(moyenne ajustée)b
Différence par rapport au groupe traité par
placebo + metformine + glimépiride (moyenne
Monographie de VICTOZA® (liraglutide)
Page 44 sur 62
Victoza® (1,8 mg) +
Placebo +
Insuline glargine +
metformine +
metformine +
metformine +
Intervalle de confiance à 95 %
Patients (%) ayant atteint un taux d'A1c < 7 %
Glycémie à jeun (mmol/L) (moyenne)
Changement par rapport à la valeur initiale
(moyenne ajustée)b
Poids corporel (kg) (moyen)
Changement par rapport à la valeur initiale
(moyenne ajustée)b
a Population en intention de traiter avec le report des dernières observations
b Moyenne, par la méthode des moindres carrés, ajustée sur les valeurs initiales
** Valeur
p < 0,0001
TRAITEMENT D'ASSOCIATION AVEC LA METFORMINE ET L'INSULINE6
Dans le cadre de cette étude ouverte de 26 semaines, les 987 patients inscrits suivaient une
monothérapie par metformine (≥1500 mg/jour) ou prenaient la metformine (≥1500 mg/jour) en
association avec une sulfonylurée, mais ces traitements ne maîtrisaient pas adéquatement la
glycémie (taux d'HbA1c de 7 à 10 % et de 7 à 8,5 % respectivement). Les patients suivant le
traitement d'association ont cessé de prendre la sulfonylurée au début de la période préliminaire
(semaine -12). Tous les patients inscrits ont entrepris une période préliminaire de 12 semaines
pendant laquelle ils ont reçu VICTOZA® comme thérapie d'appoint, dont on a graduellement
porté la dose à 1,8 mg une fois par jour. Le changement le plus marqué dans le taux d'HbA1c et
le poids corporel a été observé pendant la phase préliminaire de 12 semaines; les sujets dans les
groupes randomisés présentaient un taux moyen d'HbA1c de 8,3 % lors de la sélection, et ce
taux est passé à 7,6 % pendant la période préliminaire, alors que le changement de poids observé
a été de 3,5 kg. À la fin de la période préliminaire sous VICTOZA® (1,8 mg) et metformine, 498
patients (50 %) présentaient un taux d'HbA1c inférieur à 7 % et ont poursuivi le traitement dans
une phase observationnelle sans randomisation. Cent soixante-sept des autres patients (17 %) se
sont retirés de l'étude pendant la phase préliminaire, et environ la moitié de ces retraits étaient
attribuables aux effets indésirables d'ordre gastro-intestinal
[voir EFFETS INDÉSIRABLES]. Il
restait donc 323 patients présentant un taux d'HbA1c ≥ 7 % (33 % des sujets ayant participé à la
phase préliminaire), qu'on a randomisés pour recevoir pendant 26 semaines soit l'insuline
détémir comme thérapie d'appoint, administrée chaque soir (n = 162), soit le même traitement
par VICTOZA® à 1,8 mg et la metformine (n = 161). La dose initiale de l'insuline détémir était
de 10 unités par jour et la dose moyenne à la fin de la période de 26 semaines post-randomisation
était de 39 unités par jour (0,41 U/kg). Pendant la période de traitement de 26 semaines suivant
la randomisation, le pourcentage de patients s'étant retirés de l'étude en raison d'un traitement
inefficace a été de 3,1 % chez les sujets randomisés pour continuer à recevoir 1,8 mg de
VICTOZA® et la metformine et de 1,2 % chez les sujets randomisés pour recevoir l'insuline
détémir comme thérapie d'appoint. Le taux d'abandons total a été de 21,1 % (n = 34) chez les
Monographie de VICTOZA® (liraglutide)
Page 45 sur 62
sujets randomisés pour continuer à recevoir 1,8 mg de VICTOZA® et la metformine et de 11,1 %
(n = 18) chez les sujets randomisés pour recevoir l'insuline détémir comme thérapie d'appoint.
L'ajout de l'insuline détémir au traitement par VICTOZA® à 1,8 mg et metformine a donné lieu à
une baisse statistiquement significative de l'HbA1c comparativement au traitement inchangé se
limitant à 1,8 mg de VICTOZA® en association avec la metformine (tableau 8).
Tableau 8 : Résultats d'un essai ouvert d'une durée de 26 semaines comparant l'insuline détémir en
thérapie d'appoint avec l'association VICTOZA®-metformine au maintien d'un traitement par
VICTOZA® et metformine seulement chez des patients n'ayant pas obtenu un taux d'HbA1c
inférieur à 7 % après 12 semaines sous metformine et VICTOZA® (Semaines -12 à 0)
Victoza® + metformine
+ insuline
Population en intention de traiter (n)
HbA1c (%)
Moyenne au départ (après la randomisation, Semaine 0)
Changement par rapport à la valeur initiale (moyenne ajustée)
Différence par rapport au groupe traité par Victoza
® +
metformine (moyenne ajustée)
Intervalle de confiance à 95 %
Proportion estimative de patients ayant atteint taux d'HbA1c < 7 % c
Glycémie à jeun (mmol/L)
Moyenne au départ (après la randomisation, Semaine 0)
Changement par rapport à la valeur initiale (moyenne ajustée)b
Poids corporel (kg)
Valeur initiale (après la randomisation, Semaine 0)
Changement par rapport à la valeur initiale (moyenne ajustée)b
a Population en intention de traiter avec le report des dernières observations. Les sujets pour lesquels on n'avait pas de données après la valeur initiale ont été exclus de l'analyse. b Moyenne, par la méthode des moindres carrés, tirée d'une analyse de covariance ayant comme facteurs le traitement, le pays et l'antidiabétique oral antérieur, et utilisant la valeur initiale comme covariable c Estimations à partir d'un modèle de régression logistique utilisant le traitement comme effet fixe et le taux d'HbA1c initial comme covariable *Valeur
p < 0,0001
Monographie de VICTOZA® (liraglutide)
Page 46 sur 62
Patients atteints de diabète de type 2 présentant une insuffisance rénale :
Dans le cadre d'un essai à double insu visant à comparer l'efficacité et l'innocuité du liraglutide
à 1,8 mg par rapport au placebo (comme traitement d'appoint à l'insuline et/ou à un
antidiabétique oral) chez les patients atteints de diabète de type 2 et d'insuffisance rénale
modérée, le liraglutide s'est avéré supérieur au placebo pour réduire le taux d'HbA1c après
26 semaines (-1,05 % p/r à -0,38 %). La différence estimée entre les traitements était de -0,66
(IC à 95 % [-0,90, -0,43]),
p < 0,0001. La variation moyenne estimée du poids à la semaine 26
par rapport au départ était de -2,41 kg dans le groupe sous liraglutide et de -1,09 kg dans le
groupe sous placebo.
PHARMACOLOGIE DÉTAILLÉE
Des études pharmacodynamiques ont démontré que le liraglutide est un puissant agoniste sélectif et complet du récepteur cloné du GLP-1 humain et des récepteurs clonés du singe, du porc, du lapin, du rat et de la souris. Les principaux mécanismes moléculaires du profil d'action prolongée du liraglutide sont l'auto-association (qui se traduit par une absorption lente), la liaison à l'albumine et une stabilité enzymatique accrue contre la dipeptidyl peptidase IV (DPP-IV) et l'endopeptidase neutre (NEP). L'apparente réduction d'activité en présence d'albumine indique que seule la fraction libre du liraglutide est responsable de son effet pharmacologique
in vitro ainsi que
in vivo.
L'effet hypoglycémiant du liraglutide a été étudié sur des souris, des rats et des porcs. Il s'est
révélé être dû à la sécrétion glucodépendante d'insuline, à la réduction glucodépendante du
glucagon, au ralentissement de la vidange gastrique et à l'augmentation de la masse des cellules
bêta (uniquement pendant la phase de diabète).
TOXICITÉ
Toxicité d'une dose unique
Des études standard portant sur une dose unique ont été réalisées sur des souris et des rats, et une
étude portant sur la dose maximale tolérée a été menée sur le singe. Une dose unique de
10 mg/kg a été généralement bien tolérée par les souris et les rats, sans mortalité. Chez le singe,
une administration unique sous-cutanée de 5 mg/kg a été bien tolérée, sans mortalité. La
réduction du poids corporel et de la consommation alimentaire observée peut être considérée
comme étant induite par le médicament.
Toxicité de doses répétées
Des études pivots à doses répétées ont été effectuées sur des souris, des rats et des singes
cynomolgus. Un aperçu du programme toxicologique est présenté dans les tableaux ci-dessous.
Tableau 9
Identification de l'étude
NN203261
NN204082
Monographie de VICTOZA® (liraglutide)
Page 47 sur 62
Identification de l'étude
NN203261
NN204082
Médicament
Voie d'administration
Étude principale : 5 groupes : 10 mâles,
Étude principale : 4 groupes : 10 mâles,
10 femelles/groupe
10 femelles/groupe
Étude satellite : 5 groupes : 16 mâles,
Étude satellite : 4 groupes : 28 mâles,
16 femelles/groupe
28 femelles/groupe Étude des anticorps : 4 groupes, 5 à 15 mâles, 5 à 15 femelles/groupe
Groupes de traitement
0,0; 0,1; 0,5; 1,0; 5,0
0,0; 0,2; 1,0; 5,0
(mg/kg/jour) Durée
DSEO < 0,1 mg/kg
DSEO < 0,2 mg/kg
DSENO < 0,2 mg/kg
Identification de l'étude
NN980183
NN980189
NN200239
Rats/Sprague-Dawley
Rats/Sprague-Dawley
Rats/Sprague-Dawley
Médicament
Voie d'administration
Étude principale : 4 groupes :
Étude principale : 4 groupes :
4 groupes : 15 mâles,
10 mâles, 10 femelles/groupe
10 mâles, 10 femelles/groupe
15 femelles/groupe
Étude satellite : 3 groupes :
Étude satellite : 4 groupes :
10 mâles, 10 femelles/groupe
10 mâles, 10 femelles/groupe Étude du rétablissement : 2 groupes : 5 mâles, 5 femelles/groupe
Groupes de traitement
0,0; 0,1; 0,25; 1,0
0,0; 0,1; 0,25; 1,0
0,0; 0,1; 0,25; 1,0
(mg/kg/jour) Durée
13 semaines de traitement +
4 semaines de rétablissement
DSEO < 0,1 mg/kg
DSEO < 0,1 mg/kg
DSEO < 0,1 mg/kg
Identification de l'étude
NN980184
NN990191
NN200241
Singes cynomolgus
Singes cynomolgus
Singes cynomolgus
Médicament
Voie d'administration
4 groupes : 3 mâles,
Étude principale : 4 groupes :
Étude principale : 4 groupes :
3 femelles/groupe
4 mâles, 4 femelles/groupe.
4 mâles, 4 femelles/groupe.
Étude du rétablissement :
Étude du rétablissement :
2 groupes : 2 mâles,
2 groupes : 2 mâles,
2 femelles/groupe
2 femelles/groupe
Groupes de traitement
0,0; 0,05; 0,5; 5,0
0,0; 0,05; 0,5; 5,0
0,0; 0,05; 0,5; 5,0
(mg/kg/jour) Durée
13 semaines de traitement +
52 semaines de traitement +
2 semaines de rétablissement
4 semaines de rétablissement
Monographie de VICTOZA® (liraglutide)
Page 48 sur 62
DSEO < 0,05 mg/kg
DSEO < 0,05 mg/kg
Chez les souris, les rats et les singes, une diminution du gain pondéral et de la consommation
alimentaire a été observée durant les premières semaines du traitement et a été attribuée à
l'action pharmacologique du liraglutide. Par la suite, le gain pondéral et la consommation
alimentaire étaient généralement comparables à ceux du groupe témoin. Pour toutes les espèces,
on n'a observé aucun effet toxicologique significatif sur l'hématologie, sur la chimie clinique et
sur les paramètres urinaires. Cependant, chez la souris seulement, l'examen histopathologique de
la glande thyroïde a révélé une hyperplasie des cellules C pour toutes les doses, et ce, après au
moins 9 semaines de traitement. Des effets sur les cellules C (accumulation focale de cellules C)
avaient déjà été observés lors de l'étude de 4 semaines menée sur la souris, mais ces résultats
n'avaient pas été considérés comme liés au traitement. On n'a observé aucun effet sur les
cellules C lors des études de 26 semaines et de 52 semaines menées sur le rat et le singe.
On a observé une augmentation du poids du pancréas pour toutes les doses chez les singes
cynomolgus mâles lors de l'étude de 28 jours, et après 52 semaines de traitement chez les singes
des deux sexes. Des examens plus approfondis des tissus pancréatiques recueillis lors de l'étude
de 52 semaines menée sur des singes ont démontré que l'augmentation du poids du pancréas était
due à une augmentation de 67 % de la masse absolue des cellules canalaires et à une
augmentation de 64 % des cellules exocrines par rapport au groupe traité par l'excipient.
Toutefois, on a observé une morphologie histologique normale du pancréas dans toutes les
études, et aucune modification clinique ou biochimique n'a été observée dans le cadre de l'une
ou l'autre des quatre études réalisées sur des primates non humains. En outre, aucun effet sur le
poids du pancréas n'a été observé dans le cadre d'une étude mécaniste de 87 semaines réalisée
sur des singes cynomolgus.
Cancérogénicité
Une étude de cancérogénicité d'une durée de 104 semaines a été réalisée sur des souris mâles et
femelles, avec des doses de 0,03; 0,2; 1,0 et 3,0 mg/kg/jour administrées en bolus par injection
sous-cutanée. Les valeurs en multiples de l'exposition humaine (sur la base de la comparaison de
l'ASC0-24 plasmatique) pour les doses de 0,03; 0,2; 1,0 et 3,0 mg/kg/jour étaient de 0,2; 1,8; 10,0
et 45,0. Le traitement a entraîné une augmentation de l'incidence de l'hyperplasie focale des
cellules C chez les mâles et les femelles aux doses de 1,0 et 3,0 mg/kg/jour, et chez les femelles à
la dose de 0,2 mg/kg/jour; les taux d'incidence aux doses de 0; 0,03; 0,2; 1,0 et 3,0 mg/kg/jour
étaient respectivement de 0 %, 0 %, 1,5 %, 16,4 % et 38,0 % chez les mâles, et de 0 %, 0 %,
10,4 %, 10,5 % et 33,3 % chez les femelles. On a aussi observé une augmentation liée à la dose
des adénomes bénins des cellules C thyroïdiennes dans les groupes recevant 1,0 et
3,0 mg/kg/jour, avec des incidences de 13 % et 19 % chez les mâles, et de 6 % et 20 % chez les
femelles, respectivement; on n'a pas observé d'adénomes des cellules C dans les groupes
témoins ni dans les groupes recevant 0,03 et 0,2 mg/kg/jour. On a observé des carcinomes malins
des cellules C liés au traitement chez 3 % des femelles recevant 3,0 mg/kg/jour. Les tumeurs des
Monographie de VICTOZA® (liraglutide)
Page 49 sur 62
cellules C thyroïdiennes sont rarement observées lors des épreuves de cancérogénicité chez la
souris. En outre, on a remarqué une augmentation liée au traitement des fibrosarcomes au niveau
des tissus cutanés et sous-cutanés du dos, soit les surfaces du corps utilisées pour l'injection des
médicaments, chez les mâles recevant 3 mg/kg/jour. On a attribué ces fibrosarcomes à la forte
concentration locale de médicament à proximité du site d'injection. La concentration de
liraglutide dans la formule clinique (6 mg/mL) est 10 fois plus élevée que sa concentration dans
la formule utilisée (0,6 mg/mL) pour administrer 3 mg/kg/jour de liraglutide à des souris au
cours de l'étude de cancérogénicité. La DSENO pour cette étude est de 0,03 mg/kg/jour.
Une étude de cancérogénicité d'une durée de 104 semaines a été réalisée sur des rats mâles et
femelles, à des doses de 0,075, de 0,25 et de 0,75 mg/kg/jour, administrées en bolus par injection
sous-cutanée, ce qui correspond à 0,5, 2,2 et 7,6 fois l'exposition humaine, sur la base de la
comparaison de l'ASC0-24 plasmatique. On a observé une augmentation liée au traitement de
l'incidence et de la gravité de l'hyperplasie focale des cellules C dans les groupes recevant 0,25
et 0,75 mg/kg/jour; les taux d'incidence pour les groupes recevant 0; 0,075; 0,25 et
0,75 mg/kg/jour, respectivement, étaient de 22 %, 29 %, 40 % et 48 % pour les mâles, et de
28 %, 29 %, 55 % et 48 % pour les femelles. En outre, on a observé une augmentation liée au
traitement des adénomes bénins des cellules C thyroïdiennes chez les mâles recevant des doses
de 0,25 et 0,75 mg/kg/jour, avec des incidences de 12 %, 16 %, 42 % et 46 %, et chez les
femelles de tous les groupes traités, avec des incidences de 10 %, 27 %, 33 % et 56 % dans les
groupes recevant des doses de 0 (témoin); 0,075; 0,25 et 0,75 mg/kg/jour, respectivement. On a
observé une augmentation liée au traitement des carcinomes malins des cellules C thyroïdiennes
dans tous les groupes de mâles traités par liraglutide, avec des incidences de 2 %, 8 %, 6 % et
14 %, et chez les femelles recevant des doses de 0,25 et 0,75 mg/kg/jour, avec des incidences de
0 %, 0 %, 4 % et 6 % dans les groupes recevant des doses de 0 (témoin), 0,075; 0,25 et
0,75 mg/kg/jour, respectivement. Les carcinomes des cellules C thyroïdiennes sont rarement
observés lors des épreuves de cancérogénicité chez le rat. La DSENO pour cette étude est de
< 0,075 mg/kg/jour.
La pertinence humaine des cas de tumeurs des cellules C thyroïdiennes observés chez les rats et
les souris est inconnue et n'a pu être déterminée sur la base des résultats des études non cliniques
(voir l'encadré des mises en garde et précautions importantes).
Mutagenèse Le liraglutide ne s'est pas révélé mutagène ni clastogène, avec ou sans activation métabolique,
dans le cadre des tests suivants : test d'Ames, test de détection d'anomalies chromosomiques
dans les lymphocytes sanguins périphériques humains, et test
in vivo du micronoyau chez le rat.
Reproduction
Dans le cadre d'une étude de la fertilité et du développement embryofœtal chez le rat, on a
administré à des rats, par voie sous-cutanée, du liraglutide à des doses de 0,1; 0,25 et
1,0 mg/kg/jour. Les mâles ont été traités pendant les 4 semaines précédant l'accouplement et
pendant la période d'accouplement; les femelles ont été traitées pendant les 2 semaines précédant
Monographie de VICTOZA® (liraglutide)
Page 50 sur 62
l'accouplement et pendant la période d'accouplement, jusqu'au 17e jour de gestation. On n'a observé aucun effet négatif direct sur la fertilité des mâles pour la dose la plus élevée, qui représentait une exposition générale équivalant à 11 fois l'exposition humaine, sur la base de l'ASC plasmatique. Le gain pondéral et la consommation alimentaire ont été réduits de façon transitoire pour toutes les doses. À la dose de 1,0 mg/kg/jour, on a observé une augmentation de l'incidence de la mortalité embryonnaire précoce et une augmentation du nombre de fœtus et de portées présentant des côtes légèrement déformées. La DNESO/DSEO fœtale a donc été établie à 0,25 mg/kg /jour. Dans le cadre d'une étude sur le développement menée chez le lapin, on a administré à des femelles gravides, par voie sous-cutanée, des doses de liraglutide de 0,01; 0,025 et 0,05 mg/kg/jour du 6e au 18e jour de gestation inclusivement. Les expositions générales estimées étaient inférieures à l'exposition humaine pour toutes les doses sur la base de la comparaison de l'ASC plasmatique. Le poids fœtal a diminué et l'incidence globale des anomalies fœtales majeures a augmenté pour toutes les doses à l'essai. Des cas uniques de microphtalmie ont été observés pour toutes les doses. Étant donné que la microphtalmie est une malformation très rare et qu'elle n'a pas été observée dans le groupe témoin ni dans aucun des groupes témoins historiques, ce résultat est considéré comme lié au traitement. En outre, on a observé une augmentation de l'incidence d'os pariétaux reliés entre eux dans le groupe recevant la dose élevée, et un cas isolé de scission du sternum dans les groupes recevant des doses de 0,025 et 0,05 mg/kg/jour, résultats qui ne peuvent être considérés comme étant non liés au traitement. Les anomalies mineures considérées comme liées au traitement étaient une augmentation des cas d'os jugal relié/fusionné à un os maxillaire pour toutes les doses et une augmentation des cas de vésicule biliaire bilobée/à deux branches pour les doses de 0,025 et 0,50 mg/kg/jour. Les résultats notés dépassaient l'incidence notée dans les groupes témoins parallèles et historiques. Sur la base de ces données, la DNESO et la DSEO à l'égard de la toxicité embryofœtale n'ont pu être déterminées. Le liraglutide est considéré comme étant un agent tératogène éventuel chez le lapin en raison de l'augmentation de l'incidence des anomalies majeures notées pour toutes les doses à l'essai. Dans le cadre d'une étude prénatale et postnatale, des rats femelles gravides ont reçu des doses sous-cutanées de 0,1; 0,25 et 1,0 mg/kg/jour de liraglutide à partir du 6e jour de gestation jusqu'au sevrage ou jusqu'à la fin de l'allaitement, soit au 24e jour de l'allaitement. Les expositions générales estimées équivalaient à 0,8 fois, 3 fois et 11 fois l'exposition humaine, sur la base de l'ASC plasmatique. On a observé une réduction du gain pondéral ou une perte pondérale et une diminution de la consommation alimentaire dans tous les groupes traités, surtout pendant les 3 premiers jours de traitement. À la dose de 1,0 mg/kg/jour, à la suite de la perte pondérale initiale, la différence de poids absolue par rapport aux groupes témoins n'était pas comblée à la fin de la gestation. Des effets moindres ont été observés pour les doses plus faibles. En outre, une diminution du gain pondéral était évidente chez les femelles de la génération des progéniteurs (F0) recevant 1,0 mg/kg/jour entre le 1er et le 14e jour de l'allaitement. La taille des portées et la survie des petits étaient similaires dans tous les groupes,
Monographie de VICTOZA® (liraglutide)
Page 51 sur 62
mais une diminution du gain pondéral était évidente chez les petits de première génération filiale (F1) avant le sevrage, pour toutes les doses. La réduction du poids des ratons de première génération filiale (F1) a persisté pendant la période suivant le sevrage, mais ce n'est qu'avec la dose de 1,0 mg/kg/jour que l'on a aussi observé une réduction du gain pondéral, phénomène qui a été noté chez les femelles pendant la période d'allaitement et chez les mâles. On n'a pas observé d'effets apparents liés au traitement sur le développement, le comportement, la physiologie ou les fonctions reproductrices des animaux de première génération filiale (F1), à l'exception d'une légère réduction du poids des petits de la deuxième génération filiale (F2) pour la dose de 1,0 mg/kg/jour.
Monographie de VICTOZA® (liraglutide)
Page 52 sur 62
RÉFÉRENCES
1. Canadian Diabetes Association Clinical Practice Guidelines Expert Committee. 2003
Clinical Practice Guidelines for the Prevention and Management of Diabetes in Canada. Canadian J Diabetes 2003;27(Suppl 2):S1-S152.
2. Nauck MA, Frid A, Hermansen K et al. Efficacy and safety comparison of liraglutide,
glimepiride, and placebo, all in combination with metformin in type 2 diabetes mellitus (LEAD™-2 Met). Diabetes Care. 2009; 32:84-90.
3. Russell-Jones D, Vaag A, Schmitz O et al. Liraglutide vs insulin glargine and placebo in
combination with metformin and sulfonylurea therapy in type 2 diabetes mellitus (LEAD™-5 met+SU): a randomized controlled trial. Diabetologia. 2009; 52(10):2046-2055.
4. Gallwitz B, Vaag A, Falahati A, Madsbad S. Adding liraglutide to oral antidiabetic drug
therapy onset of treatment effects over time.
Int J Clin Pract. 2010;64(2):267-276.
5. Pratley RE, Nauck M, Bailey T et al. Liraglutide versus sitagliptin for patients with type
2 diabetes who did not have adequate glycaemic control with metformin: a 26-week, randomised, parallel-group, open-label trial.
Lancet. 2010; 375: 1447-1456
6. Morrow L, Hompesch M, Guthrie H et al. Coadministration of liraglutide with insulin
detemir demonstrates additive pharmacodynamic effects with no pharmacokinetic interaction
Diabetes, Obesity and Metabolism. 2010;13(1):75-80
Monographie de VICTOZA® (liraglutide)
Page 53 sur 62
LISEZ CE DOCUMENT POUR ASSURER UNE UTILISATION SÉCURITAIRE ET EFFICACE DE VOTRE MÉDICAMENT
VICTOZA®
Lisez attentivement ce qui suit avant de prendre VICTOZA® et chaque fois que votre ordonnance est renouvelée. Ce feuillet n'est qu'un
résumé et ne donne donc pas tous les renseignements au sujet de ce médicament. Parlez de votre problème de santé et de votre traitement
avec votre professionnel de la santé et demandez-lui s'il existe de nouveaux renseignements sur VICTOZA®.
Veuillez lire attentivement les renseignements qui suivent avant de commencer à prendre votre médicament, même si vous venez de
faire renouveler votre ordonnance. Certaines modifications pourraient avoir été apportées aux renseignements.
Rappelez-vous que votre médecin n'a prescrit ce médicament que pour vous. N'en donnez à personne d'autre.
Mises en garde et précautions importantes
Risque possible de tumeurs thyroïdiennes, parfois cancéreuses
Lors d'essais effectués sur le médicament dans le cadre d'études de longue durée, le liraglutide (l'ingrédient actif de VICTOZA®) a été administré à des rats et à des souris. Lors de ces études, le liraglutide a causé l'apparition de tumeurs médullaires de la thyroïde, dont certaines étaient cancéreuses, chez des rats et des souris. On ne sait pas si VICTOZA® est à l'origine de tumeurs thyroïdiennes ou d'un type de cancer de la thyroïde appelé cancer médullaire de la thyroïde chez l'humain. L'apparition d'un cancer médullaire de la thyroïde est rare chez l'humain, mais il s'agit d'un cancer grave et parfois fatal. Si vous présentez des tumeurs de la thyroïde, il est possible que vous ayez à subir une intervention chirurgicale pour les enlever. Si vous avez des préoccupations à l'égard des risques associés à l'utilisation de VICTOZA®, vous devriez en discuter avec votre médecin.
Raison d'utiliser VICTOZA®
VICTOZA® est utilisé en association avec de la metformine ou avec de la metformine jointe à une sulfonylurée ou à une insuline basale pour
améliorer la glycémie (taux de sucre dans le sang) chez les adultes atteints de diabète de type 2.
VICTOZA® ne doit pas être utilisé dans le traitement du diabète de type 1, auparavant appelé diabète insulino-dépendant (DID).
Effets de VICTOZA® :
VICTOZA® appartient à une catégorie de médicaments appelée analogue du GLP-1. VICTOZA® (liraglutide) aide votre corps à produire
plus d'insuline lorsque votre glycémie est élevée.
Qu'est-ce que le diabète de type 2?
Le diabète de type 2 est une maladie qui survient lorsque votre organisme ne produit pas suffisamment d'insuline ou lorsque celle-ci n'est pas
utilisée aussi efficacement qu'elle le devrait. Lorsque cette situation se produit, le sucre (glucose) s'accumule dans le sang. Cela peut
entraîner de graves problèmes.
Ingrédients de VICTOZA® :
Ingrédient médicinal : liraglutide
Ingrédients non médicinaux : phosphate disodique dihydraté, propylèneglycol, phénol et eau pour injection
VICTOZA® est offert sous les formes posologiques suivantes :
Stylo prérempli multi-dose qui peut fournir 30 doses de 0,6 mg, 15 doses de 1,2 mg ou 10 doses de 1,8 mg.
N'utilisez pas VICTOZA® si :
vous-même ou un membre de votre famille avez déjà été atteint d'un cancer médullaire de la thyroïde;
vous souffrez d'une adénomatose pluri-endocrinienne de type 2;
vous êtes allergique à l'un des ingrédients contenus dans VICTOZA® ;
vous êtes enceinte ou vous allaitez.
Monographie de Victoza® (liraglutide)
Page 54 sur 62
Consultez votre professionnel de la santé avant de prendre VICTOZA®, afin de réduire la possibilité d'effets secondaires et d'assurer
l'utilisation appropriée du médicament. Mentionnez à votre professionnel de la santé tous vos problèmes de santé, notamment si :
vous-même ou un membre de votre famille souffrez ou avez déjà souffert d'un carcinome médullaire de la thyroïde, ou vous souffrez
d'une adénomatose pluri-endocrinienne de type 2;
vous souffrez de diabète de type 1; vous avez déjà souffert d'acidocétose diabétique (augmentation de la concentration de cétones dans le sang ou l'urine); vous avez déjà eu une réaction allergique à VICTOZA®; votre fréquence cardiaque est élevée (pouls rapide);
vous souffrez d'un blocage cardiaque; vous êtes atteint d'une maladie cardiaque, telle que l'angine, des troubles du rythme cardiaque ou une insuffisance cardiaque congestive;
ou vous avez déjà été victime d'un infarctus du myocarde (crise cardiaque);
vous souffrez de problèmes rénaux; vous souffrez de problèmes du foie; vous souffrez de problèmes gastro-intestinaux (digestifs);
vous avez déjà été atteint d'une pancréatite; vous allaitez ou prévoyez allaiter; vous êtes enceinte ou prévoyez le devenir; vous présentez des vomissements et/ou une diarrhée graves et/ou une déshydratation marquée.
Au début du traitement par VICTOZA® il est possible qu'une déshydratation se produise, par exemple dans les cas où il y a des vomissements, des nausées ou de la diarrhée. Il est important de boire beaucoup de liquide pour éviter la déshydratation. Il arrive parfois qu'une hémodialyse soit nécessaire en raison d'une détérioration de la fonction rénale. Si vous avez des questions ou des préoccupations, communiquez avec votre médecin.
VICTOZA® peut accélérer la fréquence cardiaque et pourrait entraîner des changements appelés augmentation de l'intervalle PR, qui est
dépistée au moyen d'un électrocardiogramme. La fréquence cardiaque accélérée équivaut à un pouls plus rapide. Les médicaments pouvant
causer de tels effets entraînent, dans de rares cas, des variations du rythme cardiaque qui peuvent provoquer des étourdissements, des
palpitations (une sensation de battements cardiaques rapides, irréguliers ou très forts), un évanouissement ou la mort. Ces variations du
rythme cardiaque sont plus susceptibles d'arriver si vous êtes atteint d'une maladie cardiaque ou si vous prenez certains autres médicaments.
Il est important de suivre les conseils de votre médecin relatifs à la posologie de VICTOZA® ou aux examens spéciaux que vous pourriez
devoir passer. Consultez la section «
Quels sont les effets secondaires possibles de VICTOZA®? ».
Il n'est pas recommandé d'administrer VICTOZA® aux enfants de moins de 18 ans.
Informez votre professionnel de la santé de tous les produits de santé que vous prenez, y compris : médicaments, vitamines,
minéraux, suppléments naturels et produits de médecine douce. En particulier, avisez votre médecin, votre infirmière éducatrice en diabète ou votre pharmacien si vous prenez l'un ou l'autre des
médicaments suivants pour le diabète :
Un médicament à base de sulfonylurée (comme le glibenclamide et le glimépiride). La raison en est que l'utilisation de VICTOZA® de
pair avec ce médicament peut abaisser votre glycémie et causer de l'hypoglycémie.
Lorsque vous commencez à utiliser ces médicaments en même temps, votre médecin peut vous demander de baisser la dose de
médicaments à base de sulfonylurée.
Insuline. Une hypoglycémie (baisse excessive du taux de sucre dans le sang) est possible quand vous utilisez VICTOZA® avec de
l'insuline, car l'insuline augmente le risque d'hypoglycémie (voir la section «
Quels sont les effets secondaires possibles de VICTOZA®? »).
Si vous ne savez pas si les médicaments que vous prenez contiennent de la sulfonylurée, posez la question à votre médecin, à votre
infirmière éducatrice en diabète ou à votre pharmacien.
Les médicaments ci-dessous peuvent interagir avec VICTOZA® :
Voici une liste non exhaustive des médicaments qui peuvent accroître le risque de problèmes du rythme cardiaque si vous les prenez en
même temps que VICTOZA®. Vous devriez vérifier auprès de votre médecin ou de votre pharmacien avant de prendre tout autre médicament
en association avec VICTOZA® :
médicaments pour le traitement de l'hypertension;
médicaments pour le traitement de l'insuffisance cardiaque; médicaments pour le traitement d'une infection par le VIH; médicaments pour le traitement d'un trouble de déficit de l'attention avec hyperactivité; médicaments coupe-faim ou pour perdre du poids;
Monographie de VICTOZA® (liraglutide).
Page 55 sur 62
décongestionnants;
médicaments pour le traitement de l'asthme.
Comment prendre VICTOZA®
Suivez rigoureusement les directives de votre médecin concernant la prise de VICTOZA®.
VICTOZA® doit être injecté sous la peau (injection sous-cutanée). Ne l'injectez pas dans une veine ou un muscle.
Avant votre première utilisation du stylo, votre médecin ou votre infirmière éducatrice en diabète vous montrera comment l'utiliser. Les
endroits du corps les plus appropriés pour les injections sont l'avant des cuisses, la partie avant de la taille (abdomen) ou le haut des bras.
Vous pouvez vous administrer vous-même les injections à tout moment de la journée (consultez le «
Mode d'emploi »).
Ne prêtez votre stylo VICTOZA® à personne, même si l'aiguille a été changée. Ne réutilisez pas les aiguilles et ne les partagez pas avec une
autre personne (y compris un membre de votre famille). Vous éviterez ainsi la transmission d'infections.
Posologie habituelle :
VICTOZA® peut être pris à tout moment de la journée, sans égard à l'heure des repas.
La dose initiale habituelle est de 0,6 mg une fois par jour. Votre médecin vous dira combien de temps vous devez continuer à prendre cette
dose. Ce sera pendant au moins une semaine. Votre dose sera ensuite augmentée à 1,2 mg une fois par jour. Si votre glycémie n'est pas
maîtrisée avec une dose de 1,2 mg, votre médecin pourra vous dire d'augmenter la dose à 1,8 mg une fois par jour. Ne modifiez pas votre
dose à moins que votre médecin ne vous l'ait recommandé.
Vous n'aurez pas besoin de vérifier votre taux de glycémie chaque jour afin d'ajuster votre dose de VICTOZA®. Toutefois, si vous prenez un
médicament à base de sulfonylurée en même temps que VICTOZA®, votre médecin pourrait vous conseiller de vérifier votre glycémie. Cela
aidera votre médecin à déterminer si la dose de sulfonylurée doit être modifiée.
Surdose :
Si vous croyez avoir pris une dose excessive de VICTOZA®, communiquez immédiatement avec un professionnel de la santé, le service d'urgence d'un hôpital ou le centre antipoison de votre région, même si vous ne présentez aucun symptôme.
Si vous utilisez plus de VICTOZA® que prévu, parlez-en immédiatement à votre médecin. Il est possible que vous ayez besoin d'un
traitement médical. Si vous utilisez trop de VICTOZA®, vous pourriez avoir des nausées ou des vomissements.
Dose oubliée :
Si vous avez oublié une dose de VICTOZA®, prenez votre dose le lendemain, comme d'habitude. Ne prenez pas une dose supplémentaire ou
n'augmentez pas la dose le lendemain pour compenser la dose oubliée.
Ne cessez pas d'utiliser VICTOZA® sans en parler à votre médecin. Si vous arrêtez de l'utiliser, votre glycémie risque d'augmenter.
Quels sont les effets secondaires possibles de VICTOZA®?
Comme tous les médicaments, VICTOZA® peut causer des effets secondaires. Les effets secondaires suivants peuvent se produire lors de la
prise de ce médicament.
Très fréquents (touchent plus de un utilisateur sur dix)
Malaise (nausées). En général, cet effet disparaît au fil du temps;
Diarrhée.
Fréquents (touchent moins de un utilisateur sur dix)
Hypoglycémie (faible taux de glycémie). Cet effet est généralement léger. Il est plus susceptible de se produire si vous prenez également
un médicament pour le diabète appelé sulfonylurée. Les symptômes avant-coureurs d'une hypoglycémie peuvent survenir soudainement. Voici quelques-uns de ces symptômes : sueurs froides, peau pâle et froide au toucher, maux de tête, rythme cardiaque rapide, sensation de malaise, faim excessive, troubles de la vision, somnolence, sensation de faiblesse, nervosité, anxiété ou confusion, difficulté de concentration, tremblements. Votre médecin vous expliquera comment traiter une hypoglycémie et ce qu'il faut faire lorsque vous remarquez ces symptômes avant-coureurs. Si vous prenez déjà un médicament à base de sulfonylurée lorsque vous commencez à utiliser VICTOZA®, votre médecin peut vous demander de baisser la dose de la sulfonylurée;
Anorexie; Diminution de l'appétit; Maux de tête;
Monographie de Victoza® (liraglutide)
Page 56 sur 62
Vomissements; Éructations; Indigestion;
Inflammation de l'estomac (gastrite). Les symptômes comprennent des douleurs à l'estomac, une sensation de malaise (nausées) et des
Reflux gastro-œsophagien pathologique. Les symptômes incluent des brûlures d'estomac; Ventre (abdomen) douloureux ou enflé; Constipation;
Flatulence; Infection des voies respiratoires supérieures; Réactions au point d'injection (comme un bleu, de la douleur, une irritation, des démangeaisons et des éruptions cutanées); Augmentation de la fréquence cardiaque. Depuis l'introduction de VICTOZA® sur le marché, on a signalé des cas d'urticaire (un type d'éruption cutanée). Si les effets secondaires ne passent pas ou s'aggravent ou si d'autres effets secondaires qui ne sont pas énumérés dans le feuillet d'information se présentent, veuillez en informer votre médecin, votre infirmière éducatrice en diabète ou votre pharmacien.
EFFETS SECONDAIRES GRAVES : FRÉQUENCE ET MESURES À PRENDRE
Consultez votre médecin ou votre
prendre le médicament et
Dans tous les cas
votre médecin ou à votre pharmacien
Douleur thoracique ou symptômes de troubles possibles
du rythme cardiaque / étourdissements, palpitations,
évanouissement ou convulsions, cherchez à obtenir
immédiatement des soins médicaux
Pancréatite/douleur abdominale persistante, intense avec
vomissements ou non
Hypoglycémie grave/
désorientation, perte de conscience ou convulsions
Forme grave de réaction allergique (réaction
anaphylactique) avec les symptômes suivants : difficulté à respirer, enflure de la gorge et du visage et battements rapides du cœur. Vous devez obtenir des soins médicaux immédiatement.
Inflammation du pancréas (pancréatite). La
pancréatite peut être une maladie grave et mettre la vie en danger. Cessez de prendre Victoza® et communiquez immédiatement avec votre médecin si vous remarquez l'un des effets secondaires graves suivants : une douleur abdominale (dans la région du ventre) persistante et intense qui pourrait s'étendre au dos, ainsi que des nausées et des vomissements, car ils peuvent indiquer une inflammation du pancréas (pancréatite). Tumeur thyroïdienne / présence d'une masse dans le cou,
difficulté à avaler ou à respirer ou enrouement persistant
Cette liste d'effets secondaires n'est pas exhaustive. Si vous présentez un effet inattendu lors de la prise de VICTOZA®, veuillez communiquer avec votre médecin ou votre pharmacien.
Monographie de VICTOZA® (liraglutide).
Page 57 sur 62
Signalement des effets secondaires
Vous pouvez contribuer à l'amélioration de l'utilisation sécuritaire des produits de
santé pour les Canadiens en signalant tout effet secondaire grave ou imprévu à
Santé Canada. Votre déclaration peut nous permettre d'identifier de nouveaux
effets secondaires et de changer les renseignements liés à l'innocuité des produits.
3 façons de signaler :
En ligne sur le site Web de MedEffet (http://hc-sc.gc.ca/dhp-mps/medeff/index-
Par téléphone, en composant le numéro sans frais 1-866-234-2345;
En remplissant le formulaire de déclaration des effets secondaires du
consommateur et en le faisant parvenir :
o Par télécopieur, au numéro sans frais 1-866-678-6789, ou
Programme Canada Vigilance
Santé Canada Indice postal 0701E
Ottawa (Ontario)
Des étiquettes d'adresse prépayées et le formulaire de déclaration des effets
secondaires du consommateur sont disponibles sur le site Web de MedEffet
REMARQUE : Consultez votre professionnel de la santé si vous avez besoin de
renseignements sur le traitement des effets secondaires. Le Programme Canada
Vigilance ne donne pas de conseils médicaux.
Comment conserver VICTOZA®
Gardez hors de portée et de vue des enfants.
Ne prenez pas VICTOZA®
après la date de péremption indiquée sur l'étiquette et sur l'emballage. La date de péremption correspond au
dernier jour du mois indiqué.
Avant de commencer à utiliser VICTOZA®, conservez-le au réfrigérateur (2 ˚C à 8 ˚C), loin du compartiment du congélateur. Ne le
faites pas congeler.
Une fois que VICTOZA® a été utilisé, vous pouvez le conserver pendant un mois à la température ambiante (n'excédant pas 30 ˚C) ou au
réfrigérateur (entre 2 ˚C et 8 ˚C).
N'utilisez pas VICTOZA® s'il a été congelé. N'utilisez pas VICTOZA® s'il n'est pas limpide et incolore. Retirez toujours l'aiguille après chaque injection, puis rangez votre stylo VICTOZA® sans qu'une aiguille y soit fixée. Cela préviendra
contamination, infection et fuite et vous assurera également que la dose injectée est exacte.
Lorsque vous ne l'utilisez pas, laissez toujours le capuchon sur votre stylo. Cela protégera le médicament de la lumière.
N'exposez pas VICTOZA® à une chaleur excessive ni à la lumière du soleil. Les médicaments ne doivent pas être jetés dans les égouts ou avec les ordures ménagères. Demandez à votre pharmacien quelle est la
façon adéquate d'éliminer les médicaments dont vous n'avez plus besoin. Ces mesures permettront de protéger l'environnement.
Pour en savoir davantage au sujet de VICTOZA®
On peut obtenir le présent document et la monographie complète du produit, rédigée pour les professionnels de la santé, à l'adresse suivante :
http://www.novonordisk.ca ou en communiquant avec le promoteur, Novo Nordisk Canada Inc., au 1 800 465-4334.
Ce feuillet d'information a été préparé par Novo Nordisk Canada Inc.
Dernière révision : 22 mars 2016
Mars 2016
Novo Nordisk Canada Inc.
VICTOZA®, Levemir®, NovoFine® et
NovoTwist® sont des marques de commerce de Novo Nordisk A/S utilisées sous licence par Novo
Nordisk Canada Inc.
Monographie de Victoza® (liraglutide)
Page 58 sur 62
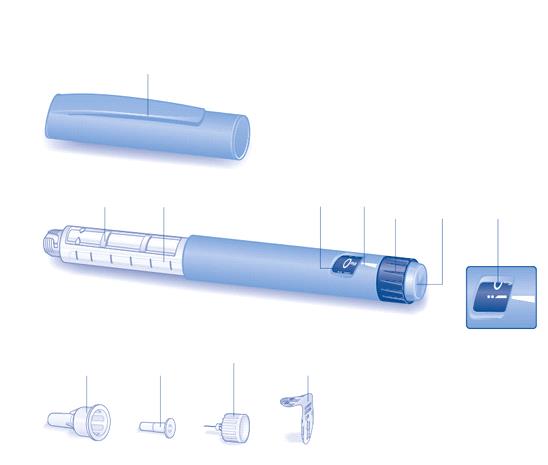
Mode d'emploi du stylo Victoza® (liraglutide)
Veuillez lire attentivement les instructions suivantes avant d'utiliser votre stylo Victoza®.
Votre stylo Victoza® contient 18 mg de liraglutide. Vous pouvez sélectionner des doses de 0,6 mg, de 1,2 mg ou de 1,8 mg.
Le stylo Victoza® est conçu pour être utilisé avec les aiguilles jetables NovoFine® d'une longueur maximale de 8 mm et d'un
calibre aussi petit que 32G.
Ne prêtez votre stylo VICTOZA® à personne, même si l'aiguil e a été changée. Ne réutilisez pas les aiguilles et ne les partagez
pas avec une autre personne (y compris un membre de votre famille). Vous éviterez ainsi la transmission d'infections.
Capuchon du stylo
Indicateur Sélecteur Bouton- Symbole de
de dose poussoir vérification
Aiguille (exemple)
Préparation du stylo Victoza®
Vérifiez le nom et l'étiquette de couleur de votre stylo pour vous assurer qu'il contient du liraglutide. Utiliser le mauvais
médicament pourrait être très dangereux pour votre santé.
A.
Retirez le capuchon du stylo.
Enlevez la languette en papier d'une nouvel e aiguille jetable. Vissez directement et solidement l'aiguille sur votre stylo.
Retirez le capuchon externe de l'aiguil e et conservez-le pour plus tard.
Retirez le capuchon interne de l'aiguil e et jetez-le.
Utilisez toujours une aiguille neuve pour chaque injection. Cette mesure de précaution réduit le risque de contamination,
d'infection, de fuite de liraglutide, d'obstruction de l'aiguille et de dose inexacte. Ne réutilisez pas les aiguilles et ne les partagez pas avec une autre personne.
Ne courbez pas l'aiguille et ne l'endommagez pas. Ne remettez pas le capuchon interne de l'aiguille après l'avoir enlevé. Vous réduirez ainsi le risque de vous blesser avec
Monographie de VICTOZA® (liraglutide).
Page 59 sur 62

Vérifiez l'écoulement du liraglutide avec un stylo neuf.
Avant de faire la première injection avec un stylo neuf, vérifiez toujours l'écoulement du liraglutide comme suit. Si
vous avez déjà utilisé votre stylo, passez à l'étape H : « Sélection de la dose ».
Symbole de
vérification
E. Tournez le sélecteur de dose jusqu'à ce que le symbole de vérification de l'écoulement soit aligné avec l'indicateur.
F.
Tenez le stylo en position verticale, aiguille pointée vers le haut. Tapotez doucement la cartouche avec votre doigt pour faire remonter les bul es d'air vers le haut.
Maintenez l'aiguille pointée vers le haut et appuyez sur le bouton-poussoir jusqu'à ce que l'afficheur indique 0 mg. Une
goutte de liraglutide devrait apparaître à la pointe de l'aiguil e. Si aucune goutte n'apparaît, répétez les étapes E à G
jusqu'à quatre fois. Si aucune goutte de liraglutide n'apparaît après quatre fois, changez l'aiguille et répétez les étapes E
à G encore une fois. Si vous ne voyez toujours pas une goutte de liraglutide, n'utilisez pas le stylo. Cela signifie qu'il est
défectueux et que vous devez en utiliser un nouveau.
Si vous avez échappé votre stylo sur une surface dure ou que vous soupçonnez une anomalie, mettez une nouvelle aiguille
jetable et vérifiez l'écoulement avant de procéder à une injection.
Sélection de la dose
Vérifiez d'abord que l'afficheur indique 0 mg.
0,6 mg
sélectionné
1,2 mg
sélectionné
1,8 mg
sélectionné
Monographie de Victoza® (liraglutide)
Page 60 sur 62
Tournez le sélecteur de dose jusqu'à ce que l'afficheur indique la dose voulue (0,6 mg, 1,2 mg ou 1,8 mg).
Si vous avez sélectionné une mauvaise dose par erreur, il suffit de tourner le sélecteur de dose dans un
sens ou dans l'autre jusqu'à ce que la bonne dose soit indiquée. Lorsque vous tournez le sélecteur de dose vers l'arrière, veillez à ne pas enfoncer le bouton-poussoir, car du liraglutide pourrait s'échapper.
Si le sélecteur de dose s'arrête avant que l'afficheur indique la dose voulue, il ne reste pas suffisamment de liraglutide pour une dose complète. Vous pouvez alors :
Diviser votre dose en deux injections :
Tournez le sélecteur de dose dans un sens ou dans l'autre jusqu'à ce que l'afficheur indique 0,6 mg ou 1,2 mg. Procédez à l'injection. Préparez un nouveau stylo et injectez le reste de la dose afin de la compléter. Vous pouvez diviser votre dose entre le stylo que vous utilisez actuellement et un nouveau stylo uniquement si vous avez reçu une formation ou des conseils de la part de votre professionnel de la santé. Utilisez une calculatrice pour déterminer les doses. Si vous ne divisez pas la dose correctement, vous risquez d'injecter une quantité de liraglutide trop élevée ou trop faible.
Ou injecter la dose complète avec un nouveau stylo : Si le sélecteur de dose s'arrête avant que l'indicateur soit aligné avec 0,6 mg, préparez un nouveau stylo et procédez à l'injection de la dose complète avec le nouveau stylo.
Le sélecteur de dose émet des clics lorsque vous le tournez. Vous ne devez pas utiliser ces clics pour sélectionner la
quantité de liraglutide à injecter.
N'utilisez pas l'échelle de la cartouche pour mesurer la quantité de liraglutide à injecter, car elle n'est pas assez précise. Ne tentez pas de sélectionner d'autres doses que 0,6 mg, 1,2 mg ou 1,8 mg. Les chiffres de l'afficheur doivent s'aligner
exactement avec l'indicateur pour que la dose soit correcte.
Administration de la dose
Insérez l'aiguille dans votre peau en utilisant la technique d'injection montrée par votre médecin ou le personnel
infirmier. Suivez ensuite les instructions ci-dessous :
Appuyez sur le bouton-poussoir jusqu'à ce que l'indicateur soit aligné avec 0 mg. Veillez à ne pas toucher l'afficheur avec vos autres doigts ou à appuyer sur le côté du sélecteur de dose lors de l'injection, sinon l'injection pourrait être bloquée. Gardez le bouton-poussoir enfoncé et laissez l'aiguil e sous la peau pendant au moins six secondes. Vous vous assurerez ainsi de recevoir toute la dose.
Retirez l'aiguil e. À ce moment, vous verrez peut-être une goutte de liraglutide apparaître à la pointe de l'aiguil e. Cette situation est normale et n'a aucun effet sur la dose que vous venez de recevoir.
Guidez la pointe de l'aiguil e dans le capuchon externe sans y toucher.
Une fois l'aiguil e recouverte, poussez doucement le capuchon externe sur le stylo, puis dévissez l'aiguil e. Jetez l'aiguille de façon sécuritaire, puis remettez le capuchon du stylo en place. Lorsque le stylo est vide, jetez-le de façon sécuritaire sans qu'une aiguille y soit fixée. Veuillez jeter le stylo et l'aiguil e conformément aux exigences locales.
Monographie de VICTOZA® (liraglutide).
Page 61 sur 62
Retirez toujours l'aiguille après chaque injection, puis rangez votre stylo Victoza® sans qu'une aiguille y soit fixée.
Cela préviendra toute contamination, infection ou fuite de liraglutide et vous assurera également que la dose injectée est exacte.
Les aidants doivent manipuler les aiguilles usagées avec beaucoup de soin, afin d'éviter de se blesser.
Entretien du stylo Victoza®
Votre stylo Victoza® est précis et son utilisation est sécuritaire. Vous devez toutefois en prendre soin :
•
N'essayez pas de réparer ou de démonter votre stylo.
Protégez votre stylo de la poussière, de la saleté et de tout liquide.
Nettoyez le stylo à l'aide d'un chiffon imbibé d'un détergent doux. N'essayez pas de laver le stylo, de le submerger ou de le lubrifier, car cela pourrait l'endommager.
Information importante
Ne prêtez votre stylo Victoza® à personne.
Gardez votre stylo Victoza® hors de la portée de quiconque, surtout des enfants.
Monographie de Victoza® (liraglutide)
Page 62 sur 62
Source: http://caf.novonordisk.ca/content/dam/Canada/AFFILIATE/caf-novonordisk-ca/OurProducts/documents/victoza-product-monograph.pdf
PROYECTO BÁSICO Y DE EJECUCIÓN _ OCTUBRE 2.012: ACABADOS INTERIORES del SALÓN DE ACTOS del CENTRO CULTURAL - AULAS DE DANZA Y MÚSICA. CALLE PASADA nos 11 y 13. SOTILLO DE LA ADRADA. ÁVILA PROPIEDAD: EXCMO. AYUNTAMIENTO DE SOTILLO DE LA ADRADA 1. MEMORIA DESCRIPTIVA 2. MEMORIA CONSTRUCTIVA 3. HOJAS JUSTIFICATIVAS CTE 4. DOCUMENTACIÓN FOTOGRÁFICA 5. DOCUMENTACIÓN CATASTRAL 6. PLANING DE OBRA 7. PLAN DE CONTROL 8. PLIEGO DE CONDICIONES 9. DOCUMENTACIÓN GRÁFICA 10. ESTUDIO BÁSICO DE SEGURIDAD Y SALUD AM. ANEJO A LA MEMORIA. MEMORIA ADMINISTRATIVA P. MEDICIONES Y PRESUPUESTO
Capítulo 47: 405-411 La construcción del receptor en la información médico-farmacéutica de un medicamento de venta libre en Argentina Anahí Cuestas, Gabriela Iacoboni y Amanda Zamuner En Víctor M. Castel y Liliana Cubo de Severino, Editores (2010) La renovación de la palabra en el bicentenario de la Argentina. Los colores de la mirada lingüística.





