Viagra gibt es mittlerweile nicht nur als Original, sondern auch in Form von Generika. Diese enthalten denselben Wirkstoff Sildenafil. Patienten suchen deshalb nach viagra generika schweiz, um ein günstigeres Präparat zu finden. Unterschiede bestehen oft nur in Verpackung und Preis.
Druckversion 170607 als pdf
Aus der Medizinischen Universitätsklinik und Poliklinik Tübingen
Abteilung für Innere Medizin IV
(Schwerpunkte: Endokrinologie und Diabetologie, Angiologie,
Nephrologie und klinische Chemie)
Ärztlicher Direktor: Professor Dr. H.-U. Häring
Inflammation und Präatherosklerose bei
Insulinresistenz:
Bedeutung löslicher MCP-1-Spiegel
Inaugural-Dissertation
zur Erlangung des Doktorgrades
der Medizinischen Fakultät
der Eberhard-Karls-Universität
Björn Matthias Kocher
Dekan: Professor Dr. I. B. Autenrieth
1. Berichterstatter: Privatdozent Dr. B. Bal etshofer
2. Berichterstatter: Professor Dr. G. Tepe
Für meine Eltern Kurt und Ingrid,
und für Dich, Franziska.
1.1 Pathogenese der Atherosklerose
1.2 Monozyten Chemoattractant Protein-1
b) MCP-1-Wirkungen
c) MCP-1-Regulation
1.3 Das metabolische Syndrom
b) Pathophysiologie des metabolischen Syndroms
c) Bedeutung von Übergewicht und Fettgewebe
1.4 Fragestel ung
2.1 Probandengruppe und Basisuntersuchungen
2.2 Messung der Intima-Media-Dicke
a) Patientenvorbereitung
b) Geräteanforderungen
c) Untersuchungsablauf
d) Untersuchungstechnik
2.3 Monozyten chemoattractant Protein-1-Bestimmung
3.1 Die Studienpopulation
3.2 Einflusskaktoren auf die Intima-Media-Dicke
a) Unifaktoriel e Analyse der Intima-Media-Dicke
b) Multifaktoriel e Analyse der Intima-Media-Dicke
3.3 Einflussfaktoren auf den MCP-1-Spiegel
a) Unifaktoriel e Analyse des MCP-1
b) Multifaktoriel e Analyse auf Einflussfaktoren des MCP-1
c) Zweites Model für MCP-1
4.1 Zusammenfassung der Ergebnisse
4.2 Besonderheiten der Probandengruppe
4.3 Fettgewebe und MCP-1 im Plasma
4.4 MCP-1-Plasmaspiegel Intima-Media-Dicke
4.5 Leptin und MCP-1-Plasmaspiegel
4.6 Widersprüchliche epidemiologische Daten schließen einen
IMT-senkenden Einfluss des MCP-1 nicht aus
4.7 Weitere Einflüsse auf die IMT
a) IMT steigt im Alter
b) HDL-Cholesterin schützt vor IMT-Erhöhung
c) IL-6 und Intima-Media-Dicke
d) Studiendaten zu weitern kardiovaskulären Risikofaktoren
4.8 Weitere Einflüsse auf den MCP-1-Plasmaspiegel
a) Plasmatriglyceride induzieren in der Gefäßwand
MCP-1-Produktion
b) MCP-1 steigt mit dem Probandenalter
4.9 Einschränkungen der Ergebnisse
4.10 Übertragbarkeit der Ergebnisse
1. Einleitung _
1.1 Pathogenese der Atherosklerose:
Atherosklerose stel t eine chronisch-entzündliche Erkrankung dar, die durch
verstärkte Ansammlung von Leukozyten im Entzündungsherd der Gefäßwand
zu Gefäßschäden führen kann (107).
Angestoßen wird die Atheroskleroseentwicklung durch verschiedene
Risikofaktoren (6, 96). Bis zu 248 verschiedene sind inzwischen in der
Diskussion (6, 96), darunter klassische, wie das Lebensalter, positive
Familienanamnese,
Hypercholesterinämie (10, 96, 110) und Diabetes (107).
Die Risikofaktoren schädigen die Gefäßwand (107) unter anderem durch
oxidativen Stress, das heißt durch die Bildung von reaktiven Sauerstoffspezies
wie zum Beispiel Superoxidanionen (110). Oxidativer Stress vermittelt die
Expression von Entzündungsmediatoren und Adhäsionsmolekülen (10, 22). Sie
inaktivieren außerdem gefäßprotektives, lokales NO (101).
Das niedrige NO bewirkt ebenfal s eine erhöhte Expression von
Entzündungsmediatoren und Adhäsionsmolekülen (10, 114). Der Wegfal
hemmender Faktoren löst auch verstärkte Zel teilung der glatten
Gefäßmuskulatur aus (22, 121), welche einen Zel anteil in der Plaque darstel t
Ein Mangel an NO vermittelt desweiteren eine Fehlfunktion wesentlicher
atherosklerotische
„endotheliale Dysfunktion" (10, 96, 135) begünstigt so die Entwicklung einer
Entzündung in der frühen atherosklerotischen Läsion, durch Erhöhung der
Monozytenmigration (22, 62) und durch verstärkte Bildung von
Adhäsionsmolekülen und Zytokinen (10, 96, 114).
Es sind daran verschiedene Adhäsionsmoleküle beteiligt:
Selektine vermitteln das „Rol ing" der Leukozyten am Gefäßendothel (96 107).
Die Proteine intercel ular adhesion molecule-1 (ICAM-1) und vascular cel
adhesion molecule-1 (VCAM-1) sorgen durch Interaktion mit ihren jeweiligen
Rezeptoren für die feste Bindung der Leukozyten an die Gefäßwand (96, 107).
1. Einleitung _
Diese Moleküle zur Leukozytenmigration funktionieren außerdem zusammen
mit Chemoattractant-Molekülen aus Endothelzel en, glatten Gefäßmuskelzel en
und Monozyten und vermitteln zusammen mit ihnen die transendotheliale
Diapedese von Leukozyten (11, 96, 107). Auch die anschließende Chemotaxe
im Interstitium der Gefäßwand wird vom Konzentrationsgradienten eines
Chemoattractants gesteuert (66, 96).
„Monozyten-chemoatrractant protein-1" (MCP-1) könnte deshalb durch seine
Lotsenfunktion für Monozyten in der Pathogenese der Atherosklerose eine
wichtige Rol e spielen (77, 98, 112).
Im Inflammationsmodus verstärken vorhandene Zytokine die MCP-1-mRNA-
Bildung in Endothel- und glatten Gefäßmuskelzel en (98). Eingewanderte
Monozyten und Schaumzel en können wiederum eine Vielzahl an
Wachstumsfaktoren, Zytokinen und Chemokinen sezernieren und so die
weitere Rekrutierung von Monozyten anregen (31, 96). Außerdem präsentieren
sie aufgenommene Antigene den T-Zel en und verstärken so die
entzündungsauslösende Zytokinfreisetzung (96).
Die Rekrutierung von Monozyten stel t, als zentraler Prozess einer
Entzündungsreaktion (32, 77, 114), einen wichtigen Schritt bei der Initiation und
Progression der Atherosklerose dar (25, 77, 114). Circa 80% der Leukozyten
atherosklerotischen
Makrophagen (32). In der Pathogenese der Atherosklerose hat die
Entzündungsreaktion in Form der Adhäsionsmoleküle, Leukozytenmigration
und verstärkende Zytokinfreisetzungen einen essentiel en Anteil (112, 114) und
geht als auslösendes Ereignis dem vaskulären Remodel ing voraus (12).
Im subendothelialen Raum angekommen, differenzieren die Monozyten zu
Makrophagen (98, 112). Sie nehmen vor Ort insbesondere oxidierte
Lipoproteine und Lipide auf (44, 47, 69, 98) und entwickeln sich dadurch zu
einer Ansammlung von lipidbeladenen „Schaumzel en" (47, 69, 107, 112).
1. Einleitung _
Damit ist das erste Stadium einer manifesten Atherosklerose, der sog. „fatty
streak" erreicht (69, 95, 96).
Als weitere Schritte der Atherosklerose bewirken lokale Zytokine (31, 58, 103)
zusammen mit Wachstumsfaktoren aus Monozyten (40, 58, 96) eine
Zel vermehrung und einen Umbau der extrazel ulären Matrix (31, 40, 58, 96):
glatte Muskelzel en der Gefäßwand wandern in die Intima ein, teilen sich dort
und beginnen mit der Sekretion von Matrixprodukten (103). Sie bilden so die
„intermediäre Läsion" als nächstes Stadium der Gefäßverkalkung (96).
Die anhaltende Zel einwanderung und Zel proliferation führt zu Vergrößerung
der atherosklerotischen Läsion und durch Anhalten bindegewebiger
Transformation des Interstitiums zur Bildung einer „fibrösen Kappe" (96, 107,
Atherosklerotische Plaques mit einem nekrotischen Lipidkern und einer fibrösen
Kappe gegen das Gefäßlumen stel en als sogenannte „organisierte Plaque" das
nächste Stadium der Atherosklerose dar (69).
Im weiteren Verlauf können die extrazel uläre Matrix und die fibröse Kappe
durch proteolytische Enzyme aus Makrophagen degradiert werden, was im
Endstadium einer solchen sogenannten „komplizierten Läsion" zu Instabilität
und Rupturneigung der Plaques führt (25, 44, 96).
1.2 Monozyten Chemoattractant Protein-1:
MCP-1 wurde am Menschen von Matsushima et al. 1989 erstmals beschrieben
(74, 91). Sein Gen ist auf Chromosom 17q11.2-12 lokalisiert (91, 92).
beziehungsweise Makrophagen (74, 81, 128, 133), Endothelzel en (23, 127,
133), glatte Muskelzel en (81, 93, 98, 128) und Fettgewebe (38, 101) gebildet.
Dabei spielen im Atherom Makrophagen und Endothelzel en als initiale Quel e
des MCP-1 eine wichtige Rol e (25).
1. Einleitung _
Die MCP-1-Expression ist erwartungsgemäß in atherosklerotischen Läsionen
erhöht (32, 130). Es wurde in vivo am Hasen und am Menschen gezeigt, dass
MCP-1 vor al em in Schaumzel en enthalten ist und weder in gesunden
Gefäßen noch in Gefäßmuskelzel en der Tunica media atherosklerotischer
Gefäße zu finden ist (130).
Außerdem wird es auch in Hautfibroblasten (81, 128, 133), Epithelzel en (83,
128, 130) Lymphozyten (81, 83) und Mesangiumzel en (31, 83) produziert.
MCP-1 zählt zur Gruppe der Chemokine (58, 91, 122). Dies ist eine Familie von
Proteinen, die den Leukozytenverkehr in Entzündungsgebiete regeln (122). Es
sind derzeit 40 bis 50 verschiedene Chemokine bekannt (91). Wegen ihrer
ähnlichen Aminosäuresequenz haben al e Chemokine eine ähnliche Sekundär-
und Tertiärstruktur (91).
Ihre typische Domäne, das Zugehörigkeitskriterium zur Gruppe, ist das
Vorliegen von 4 Cysteinresten in hochkonservativer Position (91).
Die Chemokine gliedern sich in Untergruppen nach der Position der N-
terminalen Cysteinreste (59, 122). Die „CC-Familie" oder „β-Chemokinfamilie",
zu der MCP-1 gehört (59, 91, 92, 101), hat am N-Terminus 2 Cysteine in Folge
b) MCP-1-Wirkungen:
Auf Monozyten wirkt MCP-1 chemotaktisch (64, 74, 81, 92) und vermittelt damit
eine Monozytenrekrutierung aus dem Blutkreislauf (101). Hieraus kann später
eine chronische Gefäßentzündung entstehen (25, 32).
Es reguliert das Adhäsionsmolekül β2-Integrine hoch (52, 91), und verstärkt
damit die Monozytenadhäsion am Endothel und begünstigt deren Diapedese.
Es löst außerdem die Monozytenaktivierung aus (74, 101), deren Folge die
Synthese (94) und Freisetzung von Superoxidanionen, lysosomalen Enzymen
und Chemokinen in, beziehungsweise aus den Monozyten ist (32, 52, 92, 133).
Diese Reaktion wird als sogenannter „respiratory burst" verstanden (32, 52, 92),
1. Einleitung _
was wiederum oxidativen Stress auslöst (32). Die Aktivierung der Monozyten
bedeutet auch ihre Differenzierung zum Makrophagen (101).
Der Schlüsselmechanismus des respiratory burst ist ein durch MCP-1
ausgelöster Calciumeinstrom in den Monozyten (52, 92, 94). Al erdings sind zu
dieser Aktivierung weitere Signale nötig (41, 91). MCP-1 erhöht in einer Art
„priming effect" die Empfindlichkeit der Monozyten gegenüber weiterer
entzündlicher Stimuli (41).
An Monozyten stimuliert es die Il-1- und Il-6-Produktion und wirkt damit
proinflammatorisch (52).
MCP-1 vermittelt auch eine phänotypische Differenzierung, Proliferation im und
Migration von glatten Muskelzel en der Muskelschicht in das Atherom (31, 41,
52, 103). Hierzu bedarf es eine höhere MCP-1-Konzentration als für die
Wirkungen an Monozyten (41).
Phosphatidylinositol-3-Kinase (PI-3-Kinase) (103). Sie begünstigt den Eingang
in die S-Phase des Zel zyklus durch Hochregulation eines Proteins der
Zel zyklussteuerung (103).
Im glatten Muskel bewirkt die MCP-1-Bindung an seinen Rezeptor außerdem
eine verstärkte Bildung von tissue factor (25, 32, 103) und begünstigt so
Thrombosen nach Plaqueruptur (25, 103).
MCP-1 bewirkt eine Endothelzel migration nach Gefäßwandverletzung und
begünstigt so den Wundverschluß in der Gefäßwand (52).
MCP-1 beeinflusst auch Zel en des Immunsystems: In vitro wirkt MCP-1 auf
CD-4-positive und CD-8-positive T-Zel en chemotaktisch (11, 64, 91). Des
Weiteren findet sich auch chemotaktische Beeinflussung (11, 64) von
Mastzel en (64), basophilen Granulozyten (64) und NK-Zel en (44), wobei die
Wirkung auf Monozyten wesentlich stärker ausgeprägt ist (41).
1. Einleitung _
An CD 8-positiven Zel en und an NK-Zel en löst es eine Ausschüttung
intrazel ulärer Granula aus (91), aktiviert die NK-Funktion (91) und verstärkt so
als Costimulator der T-Zel aktivierung die zytotoxische Wirkung von
Lymphozyten und NK-Zel en (11).
In basophilen Granulozyten kann MCP-1 eine Histaminausschüttung bewirken
MCP-1 vermittelt seine Wirkung dabei hauptsächlich durch Bindung an einen
mit sieben transmembranösen Domänen ausgestattenten spezifischen
Rezeptor (44, 85, 91), dem CC-Chemokinrezeptor 2 (CCR-2) (11, 131). Außer
bei Monozyten (122) wurde der Rezeptor auf Endothel (122), und glatten
Muskelzel en (103, 122) nachgewiesen.
Auch die Chemokinrezeptoren CCR-1, CCR-3, CCR-5 und CCR-10 können
MCP-1 binden (101).
CCR-2 existiert durch unterschiedliches, posttranskripitionel es splicing (91) in
zwei homologen Isoformen (44, 91), deren einziger Unterschied im
carboxyterminalen, intrazel ulären Bereich des Proteins liegt (44, 91). Sie haben
keine unterschiedlichen Bindungseigenschaften für Liganden (91). Während
CCR-2B die vorherrschende Form an menschlichen Monozyten ist, ist von der
CCR-2A-Isoform derzeit weder die exakte Lokalisation noch ihre Funktion
bekannt (44, 91).
CCR-2 hat unter den Chemokinen verschiedene Agonisten (11, 91): so bindet
neben MCP-1 auch MCP-3 und MCP-5 (11). Diese sog. "overlapping specifity"
ist Eigenart al er CC-Chemokinrezeptoren und umfasst viele Chemokine als
pathophysiologischer Bedeutung, denn jedes Chemokin bindet an eine
Rezeptorenkombination
Kombinationsmöglichkeiten einzigartige Antworten hervorrufen können (91).
Außerdem wird unter bestimmten Bedingungen nur eine Chemokinart
exprimiert, während andere mit ähnlichen Wirkungen hierbei unbedeutend
1. Einleitung _
Der CCR-2-Rezeptor vermittelt seine Wirkung über einen G-Protein-vermittelten
Pathway (11, 44, 85): die Rezeptoraktivierung bewirkt über ein inhibitorisches
G-Protein eine Hemmung der cAMP-Produktion (91).
Es sind aber auch weitere Pathways beteiligt, denn MCP-1 bewirkt auch eine
Aktivierung der Phosphatidylinositol-3-Kinase (PI-3-Kinase) und eine Hemmung
der Mitogen-activated protein-kinase (MAPK) (91, 103).
Die Bedeutung des CCR-2 für die Monozytenmigration wurde in CCR-2-
Knockoutmäusen nachgewiesen. In ihnen fand sich eine deutliche Reduktion
dieser Migration in die Gefäßwand und außerdem ein deutlich reduziertes
Ausmaß der Atherosklerose (11, 82).
Die CCR-2-Expression auf Leukozyten ist selbst wiederum stark reguliert,
vari ert abhängig von den Umgebungsbedingungen (44) und stel t so eine
weitere Möglichkeit zur Kontrol e der Leukozytenmigration dar (91).
Die proinflammatorischen Zytokine Il-1 und TNF-α, senken schnel die CCR-2-
Expression und helfen so durch den Stop reverser Transmigration
eingewanderte Monozyten im Entzündungsgebiet, wie zum Beispiel dem
Subendothelialraum, zu halten (44).
Ähnliche Auswirkung scheinen Makrophagenreifungsfaktoren zu haben, denn
an fertig ausgereiften Makrophagen löst MCP-1 keine Migration mehr aus (44).
Il-2 erhöht die CCR-2-Expression, was zur Folge hat, dass chemotaktische
Fähigkeiten von exprimierenden NK- (44) und T-Zel en (44, 91) verstärkt
An Monozyten zeigt sich auch eine Regulation durch LDL und HDL, wobei in
multivariater Analyse nur die LDL/HDL-ratio signifikanten Einfluss zeigte und
nicht jeder Wert einzeln für sich (44). Dennoch lässt dies auf eine
Expressionssteigerung des CCR-2 durch LDL und eine Expressionshemmung
durch HDL schließen (44).
1. Einleitung _
c) MCP-1-Regulation:
Oxidativer Stress scheint dabei eine Art gemeinsame Endstrecke mehrer
Induktionsfaktoren und deren Signalpathways darzustel en (s.a. Abb.1.1).
Oxidativer Stress wird durch eine Vielzahl von Einflussfaktoren des MCP-1
ausgelöst (115). Die Bildung reaktiver Sauerstoffspezies wirkt als „signaling
messenger" eines intrazel ulären Signaltransduktionsweges (13). Sie vermitteln
über redoxsensitive Transkriptionsfaktoren wie nuclear factor-κB (NF-κB) und
activator factor protein-1 (AP-1) eine Zunahme der MCP-1-Expression (13, 18,
32, 46). Dazu binden die Transkriptionsfaktoren an Bindungsstel en, die für
beide Faktoren im MCP-1-Promotorbereich gefunden wurden (11, 115). Die
Bindungsstel e des NF-κB befindet sich dabei in Position -148 zum 5 Ende des
MCP-1-Gens (13, 103).
Dies wurde in glatten Gefäßmuskelzel en und Endothelzel en nachgewiesen
(13, 24). Bestätigt werden diese Ergebnisse durch Versuche mit endogenem
oder exogenem NO zur Reduktion des oxidativen Stresses, deren Folge eine
Senkung der MCP-1-Produktion war (18, 115).
Hypertonus ist ein etablierter Atheroskleroserisikofaktor, dessen genauer
Mechanismus noch nicht bekannt ist (18). In der Blutdruckregulation spielt das
Renin-Angiotensin-System eine relevante Rol e (18), so zeigen AT1-Rezeptorenblocker
blutfruckregulierende
antiatherosklerotische Eigenschaften (18, 85).
Angiotensin II erhöht nachweislich die MCP-1-mRNA-Expression in vitro in
Monozyten und glatten Gefäßmuskelzel en von Ratten (18, 85).
Wirkungsmechanismus
membrangebundenen NADH/NADPH-Oxidase durch Angiotensin II darstel en
(17, 18). Sie induziert oxidativen Stress (17, 85) indem sie Superoxide bildet,
aus welchen spontan und enzymatisch der second messenger H2O2 entsteht (18). Über H2O2 induziert Angiotensin II die Bindungsaktivität von AP-1 am MCP-1-Promotor (18).
1. Einleitung _
Angiotensin II aktiviert außerdem über eine spezifische Kinase, die MAP-
Kinase-Kinase (MEK), die Mitogen activated protein kinase (MAPK) (18). Es
führt also auch auf diesem Weg zu einer gesteigerten MCP-1-Genexpression
Die Verbindung zwischen den beiden Pathwayfragmenten könnte eine MEK –
Aktivierung durch H2O2 sein, denn MAPK ist wiederum an der AP-1- und NF-κB-Aktivierung beteiligt (18). Dies erscheint möglich, denn in glatten
Gefäßmuskelzel en wurde bereits gezeigt, dass H2O2 eine Aktivierung der MAPK vermitteln kann (18).
Angiotensin II erhöht ferner die Stabilität der MCP-1-mRNA (18).
Bei Hypercholesterinämie findet sich eine Hochregulation von MCP-1 durch die
Lipide und deren Metabolite (25): Oxidierte Lipoproteine (77) wie oxidiertes LDL
(65, 83, 85) vermittelten durch ihre veränderten, inflammatorischen Lipide eine
Induktion von MCP-1-mRNA und dessen Proteinproduktion (32, 65, 83, 85).
Untersuchungen des Induktionsmechnismus hierbei zeigten eine Beteiligung
oxidierter Phospholipidkomponenten, die Peroxisomen-Proliferator-Activated
Rezeptor-α (PPAR-α) aktivieren können (61). Dabei löst die Bindung der
oxidierten Phospholipidkomponenten an Oberflächenrezeptoren die Aktivierung
eines second messenger pathways aus, vermutlich den Lipoxygenase-
Pathway, der aktivierende PPAR-α-Liganden produziert (61).
PPAR stel t eine Gruppe von lipidaktivierten Transkriptionsfaktoren dar, die
verschiedene Zielgene aktivieren können (61). PPAR-α bewirkt unter anderem
eine MCP-1-Induktion (61).
An Endothelzel en der Gefäßwand bewirkten bei in vitro-Versuchen auch
mechanische Scherkräfte, sogenannter „shear stress", eine MCP-1 Induktion
Der Signaltransduktionsweg hierbei wird angestoßen durch rhythmische
Dehnung der Endothelzel en (31, 126). Dadurch erfolgt eine Bildung von
reaktiven Sauerstoffspezies durch die NADPH-Oxidase (126), von deren
1. Einleitung _
induzierender Wirkung auf das MCP-1-Gen auszugehen ist (24, 126). So findet
sich bei shear stress eine Zunahme der AP-1-Transkription, einem der
redoxsensitiven Transkriptionsfaktoren (32) und eine verstärkte AP-1-
Bindungsaktivität an seiner Bindungsstel e, dem TRE-Element des MCP-1-
Promotors (126).
Aber shear stress wirkt auch über andere Wege: Er reguliert zum einen die NO-
Expression im Endothel (126). Von exogenen NO-Donatoren wurde
nachgewiesen, dass sie durch mechanische Kräfte induzierte, hohe
Superoxidspiegel senken (126). NO wirkt sich also auf die reaktiven
Sauerstoffspezies und damit auch auf die MCP-1-Induktion hemmend aus.
Zum anderen blockiert NO die Bindungsaktivität des AP-1 am MCP-1-Promoter
Mechanische Scherkräfte an der Gefäßwand wirken also über redoxsensitive
Pathways und deren Blockierung durch NO regulierend auf die MCP-1-
Proinflammatorische Zytokine induzieren ebenfal s die MCP-1-Bildung in
vaskulären Zel en (44, 77, 115). Dies sind unter anderem IL-1 (128), IL-6 (74)
und TNF-α (24). Sie entstehen unter anderem als Antwort auf inflammatorische
Die al einige Blockierung eines von reaktiven Sauerstoffspezies-abhängigen
Pathways durch Antioxidantien reicht in glatten Gefäßmuskelzel en nicht aus,
um die MCP-1-Induktion durch TNF-α vol ständig zu hemmen (24). Reaktive
Sauerstoffspezies können also nicht al eine beteiligt sein, sondern TNF-α
aktiviert verschiedene Signalwege, wie etwa ein zusätzlicher Tyrosin-Kinase-
Die Freisetzung von MCP-1 initi ert eine komplexe para- und autokrine
Feedbackschleife von Zytokinen (128). Sie bewirkt die Reifung der Monozyten
zu Makrophagen (44) und im Rahmen einer Entzündungsreaktion eine
Zerstörung der extrazel ulären Matrix (128).
1. Einleitung _
Bei Fettleibigkeit zeigen sich unterschiedliche Einflusswege auf MCP-1, so
findet sich ein erhöhter TNF-α-Spiegel (101), sowie eine vermehrte
Ausschüttung anderer Zytokine (69, 71, 112).
Das aus Fettgewebe freigesetzte Leptin löst, durch die Induktion von oxidativen
Stress an Endothelzel en, die Produktion von MCP-1 in der Gefäßwand aus (71,
83, 106). Bei oxidativem Stress wirken reaktiven Sauerstoffspezies
proinflammatorisch (83) und aktivieren gleichzeitig die MAP-Kinase, die eine
verstärkte DNA-Bindung von AP-1-Transkriptionfaktor zur Folge hat (13). Auch
der Transkriptionsfaktor NF-κB wird durch die Sauerstoffspezies aktiviert (13,
127). Sowohl AP-1- als auch NF-κB-Aktivierung geht mit verstärkter MCP-1-
Expression in Endothelzel en einher (13, 127). Der Leptineffekt auf MCP-1 ist
durch Antioxidantiengabe oder Block der Fettsäureoxidation hemmbar (13,
Gefäßmuskelzel en
Peritonealmakrophagen wurde sowohl durch natives VLDL als auch oxidiertes
VLDL, die Induktion von MCP-1-mRNA nachgewiesen (31, 98, 120). Im
Tierversuch wurde zudem eine konsekutiv verstärkte Monozytenmigration
aufgedeckt (120).
Wie bereits gezeigt stört NO an verschiedenen Stel en die MCP-1-
Induktionsmechanismen.
Der Hauptsignalpathway des NO über cGMP zeigte aber keinen Einfluss auf
MCP-1 (126, 134). Stattdessen fand sich bei NO-Hemmung eine erhöhte
Bindungsaktivität an der NF-κB-Bindungsstel e des MCP-1-Promotors (18, 134),
was bedeutet, dass NO die MCP-1-Genexpression in vitro und in vivo auf
Transkriptionsebene unterdrücken kann (115, 134).
Der molekulare Mechanismus ist hierbei wahrscheinlich die Interaktion von NO
mit Superoxid-Anionen, einer der reaktiven Sauerstoffspezies (115, 126, 134).
Eine NO-Gabe hemmt die Bildung der Superoxid-Anionen (115, 126, 134), und
1. Einleitung _
damit die NF-κB-Transkriptionsfaktor-Aktivierung und die MCP-1-Produktion
Außerdem wirkt NO, durch Interaktion mit der NADH/NADPH-Oxidase,
hemmend auf redoxsensitive Genexpression (126). Der hemmende Effekt
beruht auf der Senkung des Spiegels an reaktiven Sauerstoffen und hat damit
ebenfal s einen bremsenden Einfluss auf die MCP-1-Induktion (126).
Im Tierversuch zeigte sich in glatten Gefäßmuskelzel en ohne eigene NO-
Bildung eine erhöhte Superoxid-Produktion, erhöhte NF-κB-Aktivität, erhöhte
MCP-1-Transduktion
Monozytenchemotaxe (115). Es waren also al e Schritte eines redoxsensitiven
Signalpathways zur MCP-1-Induktion und dessen Folgen verstärkt.
Abbildung 1.1: Zusammenfassung der genannten MCP-1-Regulationsmechanismen und ihrer möglichen
Interaktionen. Schaubild enthält keine vollständige Aufstellung aller Einflüsse, weitere Einflussfaktoren und
Signalpathways sind wahrscheinlich. Induktion= , Hemmung=
1. Einleitung _
1.3 Das metabolische Syndrom:
Obwohl bereits seit über 80 Jahren Assoziationen zwischen kardiovaskulären
Risikofaktoren bekannt waren, erhielten diese Zusammenhänge erst 1988
richtiges Augenmerk unter dem Namen „Syndrom X" (2, 51, 86, 87). Seither
hatte es bereits diverse andere Namen wie „Insulinresistenzsyndrom" (51, 112)
oder „deadly quartet" (51). Die ursprüngliche Bedeutung des „Syndrom X" war
eine gemeinsame Erhöhung des Triglyceridniveaus im Plasma, des Blutdrucks
und das Vorliegen von Diabetes und Fettleibigkeit (42).
1998 wurde das Syndrom von der WHO unter dem Namen „metabolisches
Syndrom" neu definiert (51). Sie versteht darunter bei vorliegender
Insulinresistenz oder gestörter Glucosetoleranz oder Diabetes das Vorliegen
zweier der folgenden Kriterien: Übergewicht mit body mass index (BMI) > 30
kg/m² oder waist-to-hip-ratio (WHR) > 0,9 bei Männern beziehungsweise > 0,85
bei Frauen, Hypertonus, Dyslipidämie mit erhöhten Triglyceriden ≥ 1,7 mmol/l
(150 mg/dl) und/oder HDL < 0,9 mmol/l (34,6 mg/dl) bei Männern
beziehungsweise < 1,0 mmol/l (38,5 mg/dl) bei Frauen und Mikroalbuminurie
≥ 20 µg/min (2).
Das National Cholesterol Education Programm (NCEP) schuf mit dem Adult
Treatment Panel III (ATP III) 2001 eine andere, klinische Definition des
metabolischen Syndroms (2, 16, 33). Danach liegt es vor, wenn mindestens 3
der folgenden Kriterien gleichzeitig erfül t werden: erhöhter Blutdruck > 130/85
mmHg, erhöhter Hüftumfang, bei Männern > 102 cm, bei Frauen > 88 cm,
erniedrigter HDL-Level bei Männern < 40 mg/dl (1,0 mmol/l), bei Frauen < 50
mg/dl (1,3 mmol/l), erhöhter Triglyceridspiegel > 150 mg/dl (1,7 mmol/l) und
erhöhter Nüchternblutzucker > 110 mg/dl (2, 33).
Um die Verwirrung durch die uneinheitliche Definition des Syndroms zu
beenden und Studien untereinander vergleichbarer zu machen, etablierte die
International Diabetes Federation (IDF) im Konsens mit den Urhebern der
vorhandenen Definitionen 2005 eine neue, einheitliche Definition des
metabolischen Syndroms (2). Es liegt danach vor, wenn bestimmte, von
1. Einleitung _
ethnischer Zugehörigkeit und dem Geschlecht abhängige Tail enumfänge
überschritten werden (europäische Männer ≥ 94 cm, europäische Frauen ≥ 80
cm) und mindestens zwei der folgenden Kriterien erfül t werden: Triglyceride >
150 mg/dl (> 1,7 mmol/l), HDL < 40 mg/dl (< 1,03 mmol/l) bei Männer
beziehungsweise < 50 mg/dl (< 1,29 mmol/l) bei Frauen, Hypertonus ≥ 130
mmHg systolisch oder ≥ 85 mmHg diastolisch, erhöhte Nüchternglukose ≥ 100
mg/dl (≥ 5,6 mmol/l) oder bekannter Diabetes Typ 2 (2).
Gemäß den Gemeinsamkeiten der verschieden Definitionen ist das
metabolische Syndrom als eine Konstel ation aus metabolischen Störungen von
Lipid- und nicht-Lipid-Risikofaktoren für kardiovaskuläre Erkrankungen auf dem
Boden von Übergewicht und Insulinresistenz zu verstehen (40, 86). Die
verschiedenen Faktoren des Syndroms erhöhen jeder einzeln das
kardiovaskuläre Risiko unterschiedlich stark (40, 51, 117) und ihre Kombination
wiederum stärker als jeder einzelne (51, 117).
b) Pathophysiologie des metabolischen Syndroms:
Die pathophysiologischen Mechanismen sind noch nicht vol ständig verstanden
(40, 112). Die Assoziationen der verschiedenen Risikofaktoren untereinander
komplizieren Analysen auf unabhängige Zusammenhänge (42). Es wird
vermutet, dass eine gemeinsame metabolische Störung Ursache für das
gesamte Störungsmuster des Syndroms ist (42).
Einige Studien halten die Insulinresistenz für entscheidend (16, 40, 42). Sie ist
definiert als Resistenz von Gewebe gegen insulinvermittelte Glukoseverwertung
Andere Studien zeigen sowohl zwischen subkutanem als auch viszeralem Fett
eine Assoziation zu al en ATP III-Kriterien des metabolischen Syndroms (16).
Dies legt eine eigene Rol e der Fettleibigkeit bei der Entstehung des
metabolischen Syndroms nahe (16). Die Verbindung zwischen exzessivem
Bauchfett und Insulinresistenz ist seit langem bekannt (16, 55, 75, 86). Doch
nach Körpergewichtsreduktion findet sich außer einer Besserung der
1. Einleitung _
Insulinresistenz auch eine Besserung al er anderen Komponenten des
metabolischen Syndroms (34, 55).
Wie große Studien zeigten, hat die abdominel e Fettleibigkeit im Vergleich zur
generel en Fettleibigkeit das größere Potential, kardiovaskuläre Erkrankungen
auszulösen (16, 132). Dabei scheint speziel die abdominel e Fettleibigkeit auch
wesentlich stärker mit der Insulinresistenz in Verbindung zu stehen, als dies die
generel e Fettleibigkeit tut (86). Daher vermögen Messwerte für generel e
Fettleibigkeit das Erkrankungsrisiko nur unvol ständig darzustel en (132).
Als Pathomechanismus ist das metabolisch aktive Fettgewebe Quel e
verschiedener Proteine, sog. „Adipokine" oder auch „Adipozytokine" (19, 67,
101). Dies sind unter anderem Hormone wie Leptin (67, 69) und Adiponektin
(16) und verschiedene proinflammatorische Zytokine wie TNF-α (16, 19, 101)
oder Il-6 (17, 19). Wahrscheinlich vermitteln diese Moleküle das
kardiovaskuläre Risiko, das mit Fettleibigkeit einhergeht, denn das exzessiv
erhöhte Fettgewebe könnte mit einer subklinischen Inflammation (19) und der
Überproduktion dieser Zytokine einhergehen (19, 67).
Sie beeinflussen auch die unterschiedlichen Kaskaden der anderen
Fettmassewirkungen: so stimuliert TNF-α die Lipolyse im Fettgewebe und Il-6
erhöht die hepatische Triglyceridsynthese (17). Außerdem hemmen sie die
Lipoproteinlipaseaktivität und blockieren damit die Entfernung triglyceridreicher
Lipoproteine aus dem Plasma (17).
Einige Adipokine beeinflussen die Insulinwirkung: TNF-α hemmt die
Tyrosinkinasephosphorylation des Insulinrezeptors, blockiert damit die
Signalübertragung des „Insulinsignals" und löst so Insulinresistenz und gestörte
Glukoseverwertung aus (35). Im Menschen zeigte sich auch eine direkte,
positive Korrelation zwischen Il-6-Spiegeln im Blut und dem Ausmaß der
Insulinresistenz.
Es treten teils aber nur einige, nicht al e der untereinander assozi erten
Abnormalitäten des metabolischen Syndroms auf, was darauf schließen lässt,
dass keine davon ausschließlich durch die beschriebenen Pathomechanismen
1. Einleitung _
reguliert wird (86). So tragen neben der Vielzahl an Mechanismen sicher auch
individuel e Veranlagungen mit wechselnder Merkmalsausprägung zum bunten
Erscheinungsbild des Syndroms bei (86).
Die atherogene Wirkung des metabolischen Syndroms entsteht wahrscheinlich
als Ergebnis der Kombination der verschiedenen Risikofaktoren und deren
individuel en proatherogenen Wirkungen und nicht durch einen einzigen,
dominierenden Faktor (86).
c) Bedeutung von Übergewicht und Fettgewebe:
Übergewicht ist in westlichen Ländern epidemisch, 30% der erwachsenen US-
Amerikaner werden gegenwärtig als fettleibig eingeschätzt, doppelt so viele als
noch vor 20 Jahren (112, 129). Übergewichtig führt unabhängig von anderen
Risikofaktoren zu erhöhter Morbidität und Mortalität an kardiovaskulären
Erkrankungen und koronarer Herzkrankheit und zu erhöhtem Diabetesrisiko
Der weitverbreitete BMI zeigt al erdings Schwächen bei der Abschätzung des
kardiovaskulären Risikos (132). So erreichte er in vielen Studien nicht das
nötige Signifikanzniveau als unabhängiger Risikofaktor (129, 132), während
andere, weniger gebräuchliche Messwerte für Übergewicht wie der WHR oder
der Tail enumfang dies am selben Probandenkol ektiv durchaus taten (132).
Dies führte zur Betrachtung verschiedener Typen der Fettleibigkeit im Sinne der
Fettverteilung (17). Es betrifft insbesondere die viszerale Fettleibigkeit oder
auch „male type", „abdominal obesity" oder „central obesity" genannt (17).
Diese ist definiert als die vermehrte Ansammlung von Fettgewebe im viszeralen
Bereich des Abdomens und direkt über CT oder MRT messbar (12).
Epidemiologische und metabolische Studien legen nahe, dass diese viszerale
Fettansammlung als kardiovaskulärer Risikofaktor stärker ins Gewicht fäl t (9,
27, 60). Dies dürfte sich aus den besonderen Eigenschaften des viszeralen
Fettgewebes ergeben (17, 39): es besitzt eine höhere Zel dichte, mehr
1. Einleitung _
katecholamininduzierte Lipolyse und ist Quel e zahlreicher Botenstoffe (39,
Bisher sind die Mechanismen zwischen Fettgewebe und Atherosklerose aber
noch relativ unverstanden (13, 83, 106). Fettgewebe ist aber mehr als ein reiner
Fettspeicher (67). Vielmehr ist es metabolisch sehr aktiv (16, 67), endokrin und
parakrin sezernierend (71) und als solches „endokrine Organ" (69) nach dem
lymphatischen Gewebe der größte Produzent an Signalmolekülen im
menschlichen Körper (112). Al erdings ist die biologische Signifikanz der
sezernierten Moleküle größtenteils noch unbekannt (112). Bei Übergewicht und
Adipositas bewirkt das exzessiv erhöhte Fettgewebe eine Überproduktion von
Adipokinen (7, 67, 69). Reduktion der Fettmasse verbessert deren
Plasmaspiegel (7, 69). Unter den sezernierten Proteinen beeinflussen zum
Beispiel Leptin, PAI-1, TNF-α, und IL-6 die Atheroksklerose (112).
Einen möglichen Mechanismus könnten die sezernierten, proinflammatorischen
Zytokine wie Il-6 und TNF-α darstel en (57, 106, 112, 127), die entweder direkte
atherosklerosefördernde Effekte haben (57) oder indirekt über die Förderung
von Thrombose (57) und Inflammation wirken (57, 112).
Möglich ist auch die verstärkte Induktion der Monozythenwanderung durch die
Gefäßwand und ihre Umwandlung in Makrophagen (69). TNF-α und andere
Adipokine erhöhen in Endothelzel en und glatten Gefäßmuskelzel en die
Expression (69, 83) und Sekretion (83) der Adhäsionsmolküle VCAM-1 und
ICAM-1 und MCP-1 (69).
Bei erhöhtem BMI findet sich außerdem eine CRP-Erhöhung (7, 21, 57, 106),
die sich paral el zur Fettmasseschwankung verändert (21), als Hinweise auf
eine subklinische Inflammation bei Übergewicht (7, 57). Die genaue Rol e einer
solchen „Akute-Phase-Reaktion" bei der Atherokslerose ist noch unklar (57),
doch zeigt sich CRP als Prädiktor für kardiovaskuläres Risiko (86, 89, 90).
1. Einleitung _
1.4 Fragestel ung:
Der aktuel e Informationsstand über die pathophysiologischen Abläufe der
Atherosklerose und die zahlreichen bekannten Einflussfaktoren lassen nach wie
vor viele Fragen offen. Eine bessere Kenntnis der beteiligten immunologischen
und inflammatorischen Abläufe könnten viele Antworten liefern. Ein relativ
neuer Entzündungsmediator ist MCP-1. Seine bekannte Wirkung als
monozyten-anlockender Botenstoff und Befunde hoher MCP-1-Konzentrationen
in atherosklerotischen Plaques lassen den Verdacht auf eine Schlüsselrol e des
MCP-1 im Atheroskleroseablauf zu.
Das Ziel dieser Arbeit ist es, einen möglichen Zusammenhang zwischen MCP-
1-Plasmaspiegeln und dem Ausmaß einer sonographisch feststel baren
Atheroklerose in Form einer erhöhten Intima-Media-Dicke (IMT) zu
untersuchen. Außerdem sol en Zusammenhänge zwischen traditionel en
Risikofaktoren und MCP-1 ermittelt werden. Um deutlichere Effekte zu sehen
untersuchten wir ein Kol ektiv mit erhöhtem kardiovaskulärem Risiko im Sinne
eines erhöhten Diabetesrisikos. Für diese Subgruppe sind auch
Präventivmaßnahmen von besonderer Bedeutung. Zudem wurden junge
Probanden untersucht um Einflüsse durch eine bereits fortgeschrittene
Atherosklerose auszuschließen.
2.1 Probandengruppe und Basisuntersuchungen:
Die Untersuchung umfasste 172 ausgewählte Probanden, die bezüglich ihrer
Gefäßparameter untersucht wurden. Al e waren Teilnehmer der TULIP-Studie
zur Diabetesprävention der Universität Tübingen und erfül ten folgende
Einschlusskriterien: BMI > 27 kg/m2 und/oder Zustand nach Gestationsdiabetes
und/oder positive Familinenanamnese für Typ 2 Diabetes.
Ausschlusskriterien
Nüchternblutzucker
(Nüchternblutzucker > 7 mmol/l beziehungsweise > 126 mg/dl), erhöhter
Blutzucker 120 Minuten nach Glukosegabe von 40g/m2 Körperoberfläche (120
Min.-Blutzucker > 11,1 mmol/l beziehungsweise > 200 mg/dl), ausgeprägt
erhöhte Triglyceride (Triglyceride > 500 mg/dl), ausgeprägt erhöhtes
Gesamtcholesterin (Gesamtcholesterin > 300 mg/dl), Hypertonie ab
Schweregrad 3 (systol. RR > 180 mmHg oder diastol. RR > 110 mmHg),
Zeichen von Infektion oder anderweitig bedingte, signifikante CRP-Erhöhungen
(CRP > 1 mg/dl), signifikante Hyperhomocysteinämie (Homocystein > 15
mmol/l), Über- oder -Unterfunktion der Schilddrüse (TSH > 5 mU/l oder TSH <
0,2 mU/l), Typ 1 Diabetes (Glutamatdecarboxylaseautoantikörper (GAD-Ak) > 1
Probanden mit Extremwerten bei MCP-1 (MCP-1 > 400 pg/ml) wurden ebenfal s
ausgeschlossen (n = 8). Das Studienprotokol wurde vom Ethikkomitee der
Eberhardt-Karls-Universität Tübingen genehmigt.
An al en Probanden wurde eine al gemeine Anamnese mit dem Schwerpunkt
auf vaskulären Erkrankungen durchgeführt und ihr Rauchverhalten erfasst. Ihre
Angaben wurden in Pack Years umgerechnet. Um ungenaue Angaben über
bisheriges Rauchverhalten nicht in die Analyse einfließen zu lassen, erfolgte die
Gliederung der Population in aktive und nicht aktive Raucher.
Blutdruckwerte wurden mit der auskultatorischen Methode nach Riva Rocci
mittels einer handelsüblichen Blutdruckmanschette WelchAlkyn® blood
pressure cuff, Adult, Range 34,3 cm-25,3 cm und Stetoskop DeHarvey® Elite
Der BMI wurde ermittelt durch Messung des Körpergewichts mittels
mechanischer Säulenwaage (Model Seca 709, seca GmbH und CoKG,
Hammen Steindamm 9-25, Hamburg) und der Körpergröße (mittels
handelsüblicher Messlatte) und anschließender Berechnung nach der Formel:
Körpergewicht in kg/ (Körpergröße in Meter)2 .
Zur Bestimmung des waist-to-hip-ratio, also des Quotient aus Tailenumfang
zum Hüftumfang, wurden beide Umfänge mittels handelsüblichem Maßband
gemessen und der Quotient errechnet als Tailenumfang in cm/Hüftumfang in
Die Messung des prozentualen Körperfettanteils erfolgte mittels biolelektrischer
Impedanzanalyse (InBody 3.0 und InBody 4.0, Body Composition Analyser,
Biospace Co, Ltd.; Seoul, Korea). Dabei wird die Eigenschaft ausgenutzt, dass
der Widerstand des Gewebes gegen elektrischen Strom von seinem
Flüssigkeitsgehalt abhängt (16). Hoch hydriertes, fettfreies Gewebe leitet den
Strom gut, während schlecht hydriertes Fettgewebe eher einen Isolator darstel t
(16). Die Messung des leitenden Volumens beruht auf dem Prinzip des
ohmschen Gesetzes, wonach Volumen abhängt von der Länge²/elektrischen
Widerstand (16). Der vom Gerät ermittelte Impedanzindex korreliert mit der
fettfreien Körpermasse, deren Schätzungen mit den Messwerten aus dem
Referenzverfahren gut übereinstimmen (16). Aus diesem Messwert lässt sich
auf den Fettgehalt im Körper rückschließen (9).
Die von uns durchgeführte Messung erfolgt an beiden Seiten an Armen und
Beinen über 8 verschiedene Elektroden: 4 Fußelektroden an beiden Seiten, je
eine an Bal en und Ferse und 4 Handelektroden an beiden Seiten, je eine an
Daumen und Handfläche. Dies ermöglicht die getrennte Betrachtung der
Stromflüsse verschiedener Köperareale (9).
Das Gerät benutzt Wechselstrom der Stärke 250 µA in 4 unterschiedlichen
Frequenzen zwischen 5 und 500 kHz. Hierbei messen niedere Frequenzen den
extrazel ulären, die Frequenzen über 200 kHz den intrazel ulären
Flüssigkeitsgehalt und erlauben so eine getrennte Erfassung beider
Flüssigkeitskomponenten (9, 16).
Die Messung erfolgt in aufrechter, entspannter Körperhaltung am nüchternen
Probanden, vor physischer Anstrengung und nachdem die Kontaktflächen der
Elektroden durch Desinfektionslösung von Elektrolyten gereinigt wurden.
Diese besonderen Messmodalitäten beseitigen die Schwächen bisheriger
Niedervoltströmen
Messelektroden und erzielen gut reproduzierbare Ergebnisse und höchste
Messgenauigkeit in sehr guter Übereinstimmung mit Standardmessmethoden
wie der Unterwasserwägung oder Dualenergie Röntgenabsorptiometrie (9, 16).
2.2 Messung der Intima-Media-Dicke:
Die Intima-Media-Dicke, abgekürzt IMT vom international gebrauchten,
englischen „Intima-Media-Thickness", dient als diagnostisches Mittel auf frühe
strukturel e Gefäßwandveränderungen in vivo (74).
a) Patientenvorbereitung:
Die Patienten wurden nach einer 8-12-stündigen Nüchternphase gemessen.
Metabolische und inflammatorische Diagnostik erfolgte am gleichen Tag mit der
Erfassung der Intima-Media-Dicke. Die Probanden trieben vor der Messung
keinen Sport um den Vagotonus möglichst niedrig zu halten (25). Die Messung
erfolgte in einem ruhigen und klimatisierten Raum mit 21-22° Celsius.
b) Geräteanforderungen:
Es wurde ein hochauflösendes Ultraschal gerät (ESAOTE AU4, Idea
Biomedica®, München) mit einem Linearschal kopf mit 13 Mhz, axiale
Auflösung 0,12 mm, maximale Eindringtiefe 4,5 cm, mit integriertem EKG-
Modul und integrierter Aufzeichnungstechnik benutzt.
c) Untersuchungsablauf:
Der Patient wurde in einer bequemen Liegeposition mit leicht erhöhtem
Oberkörper gelagert. Einschnürende Kleidungsstücke oder Schmuck wurden
abgelegt und EKG-Elektroden aufgeklebt.
Eine spezifische Anamnese wurde erhoben. Nach Einhaltung der Ruhephase
von mindestens 10 Minuten unter Puls- und Blutdrucküberwachung, bis zum
Ausbleiben größerer Schwankungen der überwachten Parameter, erfolgte die
d) Untersuchungstechnik:
Die sonographischen Messungen erfolgten gemäß der „leading-edge-Technik"
nach Wendelhag et al. (136):
Der dreischichtige Gefäßwandaufbau, bestehend aus außen liegender Tunica
adventitia, in der Mitte gelegener Tunica media und innen gelegener Tunica
intima, stel t sich im Ultraschal in typischer Weise dar (s.a. Abb. 2.1 u. Abb.
2.2): die Adventitia als hel e Zone (Echozone 1 = EZ 1, Echozone 7 = EZ 7), die
Media als dunkle Zone (EZ 2, EZ 6). Eine Ausnahme bildet die zur Abbildung zu
dünne Intimaschicht (EZ 3, EZ 5). Sie verursacht zwar ein Schal echo, das sich
aber dicker als die tatsächliche, aus einer einzelnen Zel schicht bestehende
Intima darstel t und sich in schal kopfferne Richtung ausdehnt. Entsprechend
projeziert sich die zu dick abgebildete, hel e Schicht der schal kopfnahen Intima
ins Gefäßlumen (EZ 3), die der schal kopffernen Intima in die Media (EZ 5) (5,
6, 25, 136). Die erste, hel e Linie stel t an der schal kopffernen Gefäßwand die
Grenze Lumen-Intima dar, die zweite die Grenze Media-Adventitia. Eine
genaue Grenze zwischen Intima und Media ist aus den oben genannten,
physikalisch-sonographischen Gründen nicht sichtbar (s. Abb. 2.1) (74). Die
Messung der Dicke der Intima zusammen mit der Media erfolgt also von Beginn
der Intima, entsprechend dem lumenseitigen Beginn der EZ 5 bis zum Beginn
der Adventitia, abgebildet als lumenseitiger Beginn der EZ 7.
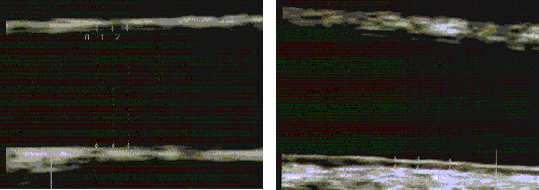
Abbildung 2.1: Schema zur Gegenüberstellung von anatomischer und sonographischer Morphologie
der Gefäßwand, EZ= Echozone
mit freundlicher Erlaubnis von Dr. K. Rittig
Die Arteria carotis communis wurde circa 1 cm proximal des Bulbus im
Längsschnitt so dargestel t, dass beide Wände als die bereits besprochene
Doppelkonturen erschienen. Am eingefrorenen Bild wurde enddiastolisch, also
zum peak der R-Zacke der simultan aufgezeichneten EKG-Kurve, gemessen.
Die IMT wurde gemäß der leading-edge-Technik mittels elektronischer Kaliper
als Abstand vom lumenseitigen Beginn des inneren Schal reflexes bis zum
lumenseitigen Beginn des äußeren Schal reflexes an der schal kopffernen
Gefäßwand gemessen. Es erfolgte die Bestimmung von je 3 Dicken aus 2
verschiedenen Schal einstrahlwinkeln an der gleichen Gefäßstel e. Aus ihnen
wurde der Mittelwert gebildet.
Abbildung 2.2: Sonographische Darstellung der A. carotis communis mittels hochauflösendem Ultraschall zur Messung der Intima-Media-Dicke. Erkennbar ist an der schal kopffernen, hier unten liegenden Gefäßwand die typische Doppelkontur
aus hellem und dunklem Schallechos.
Eine Messung an der schal kopfnahen Wand ist wegen den physikalischen
Eigenheiten nur eingeschränkt möglich, denn die Adventitia wird in die Media
hinein projeziert, sodass eine klare Bestimmung der gesuchten Wandgrenzen
hier nicht möglich ist (74).
2.3 Monozyten chemoattractant Protein-1- Bestimmung:
Das MCP-1 wurde durch einen handelsüblichen ELISA („human MCP-1 BMS
281", Bender MedSystems GmbH, Campus Vienna Biocenter 2, A-1030
Vienna, Austria) bestimmt.
Dabei binden monoklonale anti-MCP-1-Antikörper, die an ein Medium
gebunden sind, das MCP-1 aus dem Probenplasma. Dazugegebene,
enzymgebundene anti-MCP-1-Antikörper, in diesem Fal HRP-konjugiert,
binden anschließend an das bereits am Medium gebundene MCP-1. Es folgt
ein Waschvorgang mit einer Lösung PBS mit 1% Tween 20, der ungebundene,
anti-MCP-1-Antikörper entfernt. Die antikörpergebundenen HRP-Enzyme
setzten das, nach dem Waschvorgang hinzugegebene Substrat, eine Lösungen
mit Tertramethyl-Benzidine und 0.02% gepuffertem Hydrogenperoxid, zu einem
farbigen Produkt um. Die Färbung erfolgt proportional zum MCP-1-Gehalt der
Probe. Die Reaktion wird durch Phosphorsäurezugabe gestoppt und die
Adsorbanz von Licht der Wel enlänge 450 nm in einem Spektrophotometer
gemessen. Ein Vergleich zu einer Verdünnungsreihe aus sieben
Standardproben mit vorgegebener MCP-1-Konzentration lässt auf den MCP-1-
Gehalt der Probe schließen.
Die Sensitivität des Tests liegt bei einer Nachweisgrenze von 3,5 pg/ml MCP-1.
Er ist mit einem intra-assay-Variationskoeffizieten von 4,7 % und einem inter-
assay-Variationskoeffizient von 8,7 % reproduzierbar.
Zur Bestimmung der Insulinresistenz der Probanden wurde ein oraler
Glukosetoleranztest (oGTT) durchgeführt. Dazu bekamen die Probanden nach
dem Legen einer Venenverweilkanüle im Cubitalbereich oder auf dem
Handrücken (Firma Braun ®, Melsungen, 22 G) eine Glukoselösung in der
Dosis 40 g/m² Körperoberfläche zu trinken (Dextro ® O.G.T., 300ml). Sie
enthielt ein Gemisch aus Mono- und Oligosacchariden, welches nach
intestinaler Spaltung wasserfreie Glukose freisetzt. Es folgten Blutentnahmen
nüchtern, sowie 15, 30, 60, 90 und 120 Minuten nach der Glukosegabe zur
Bestimmung der Blutglukosekonzentration und der Insulinkonzentration.
Die Blutzuckerbestimmung aus den verschiedenen Proben erfolgte durch das
Analysegerät ADVIA 120 ® und dazugehörigen Reagenzienkits der Firma
Bayer (Bayer Vital GmbH, Geschäftbereich Diagnostics, Fernwald,
Deutschland). Die Insulinkonzentration der Proben wurde ebenfal s maschinel
mittels des Analysegeräts ADVIA Centaur ® der Firma Bayer bestimmt.
Der Insulinsensitivitätsindex nach Matsuda (ISI-Matsuda) errechnet sich aus
Nüchterninsulin,
Nüchternglukose,
Glukosekonzentration beim oGTT sowie der mittleren Insulinkonzentration beim
(Nüchternglukosekonzentration x Nüchterninsulinkonzentration) x (mittlere
Glukosekonzentration bei oGTT x mittlere Insulinkonzentration bei oGTT) (79).
Der HbA1c wurde durch automatisierte Hochleitstungschromatographie mit Reagenzien der Firma Chromsystems bestimmt (Reagenzien Glycated
Haemoglobin (HbA1c) in Whole Body by automated analysers, Chromsystems Instruments & Chemicals GmbH, München, Deutschland).
C-reaktives Protein wurde mittels des „C-reaktive Protein wide range (CRPwr)
Reagent Kit" Produktnummer KR00180 der Firma Scil (Scil Diagnostics GmbH,
Viernheim, Deutschland) für Analysegeräte Model ADVIA ® Chemistry
Systems der Firma Bayer (Bayer Vital GmbH, Geschäftbereich Diagnostics,
Fernwald, Deutschland) bestimmt. Dabei handelt es sich um einen
immunologischen Agglutinationstest mit Reaktionsverstärkung durch Latex:
Latex gebundene anti-CRP-Antikörper reagieren mit dem Antigen der Probe
und formen einen unlöslichen Antigen-Antikörper Komplex dessen Agglutination
turbidimetrisch gemessen wird.
Triglyceride wurden mittels eines Reagenzkits Produktnummer B01-4133-01
der Firma Bayer für ihre Analysegeräte Model ADVIA ® 1650 Chemistry
Systems in diesem Gerät bestimmt. Das Verfahren beruht auf einer Drei-Schritt-
Reaktion nach Fossati mit Trinder-Endpunkt. Der Gesamt-Triglyceridgehalt wird
bestimmt durch eine Reihe von enzymvermittelten Metabolisierungen an deren
Endpunkt ein farbiger Komplex steht, dessen Adsorbanz bei 505 nm
spektrometrisch gemessen wird.
Cholesterol wurde mit dem Reagenzkit Produktnummer B01-4124-01 der Firma
Bayer für ihr Analysegerät Model ADVIA ® 1650 Chemistry Systems in diesem
Gerät bestimmt. Die Methode basiert auf einer mehrschrittigen enzymatischen
Reaktion an deren Ende die Adsorbanz eines farbigen Komplexes bei 505 nm
Die Bestimmung des HDL-Cholesterins erfolgte mittels der „Direkt HDL
Cholesterin II (HDL II) Reagenzien" von Bayer im Model ADVIA ® 1650
Chemistry Systems des gleichen Herstel ers. Es wird dabei ohne vorherige
Separation nach einem Verfahren von Izawa et al. gemessen. Dabei wird in
einem ersten Reaktionsschritt al es Cholesterin aus Chylomikronen, VLDL und
LDL freigesetzt und eliminiert. Im zweiten Reaktionsschritt wird Cholesterin
enzymatisch aus HDL freigesetzt und die Konzentration des Produkts aus
weiteren enzymatischen Verstoffwechselungen als Quinoniminpigment bei 600
nm spektrometrisch gemessen. Die Adsorption verhält sich direkt proportional
zur Cholesterinkonzentration.
Das LDL-Cholesterin wurde bestimmt mittels dem „Direkt LDL Cholesterin
Reagenzien"-Kit von Bayer für ihren ADVIA ® 1650 durch ein
Bestimmungverfahren ohne vorherige Separation mit Trinder-Endpunkt nach
Okada et al. Ähnlich wie beim HDL wird im ersten Schritt sämtliches nicht-LDL
Cholesterin entfernt und im zweiten enzymatisch aus LDL Cholesterin
Quinoniminpigment hergestel t und gemessen.
Die Leptinbestimmung wurde durchgeführt mit einem Radioimmunoassay/RIA
(Human Leptin RIA Kit, Katalog.No.: HL81K, Linco Research, St. Charles,
Missouri, USA). Hierbei wird mit 125-Iod markiertes, humanes Leptin mit
Antiserum gegen menschliches Leptin aus Hasen inkubiert. Das Leptin des
Probandenserums verdrängt das radioaktiv markierte Antigen von den
Antikörpern. Diese erhöhte Menge ungebundenes, markiertes Leptin und die
verminderte Menge gebundenes, radioaktives Leptin wird nach Trennung
beider voneinander gemessen. Der Vergleich mit der Messserie einer Reihe
bekannter, unmarkierter Leptinkonzentrationen ermöglicht die quantitative
Bestimmung der Leptinserumkonzentration.
Die Bestimmung von Tumor-Nekrose Faktor-α (TNF-α) wurde mit dem Kit
„Quantikine ® HS Human TNF-α/TNFSF1A Immunoassay", einem ELSIA nach
der „quantitative sandwich enzyme immunoassay technique", der Firma R&D
Systems (R&D Systems, Inc., 614 McKinley Place N.E., Minneapolis, MN
55413, USA) durchgeführt.
Il-6 wurde mittels der gleichen Technik durch „Quantikine ® HS human Il-6"-Kit
ebenfal s von R&D Systems gestimmt.
Zum Ausschluss eines Diabetes mel itus Typ 1 wurden al e Probanden auf anti-
GAD-65-Antikörper untersucht und ab Werten > 1,0 U/ml von der Studie
handelsüblichem
Radioliganden Assay (CentAK®antiGAD65, MEDIPAN DIAGNOSTICA,
Selchow, Deutschland). Dabei bindet der im Probandenserum vorhandene
Autoantikörper gegen Glutaminsäure Decarboxylase 65 (GAD 65) in
pankratischen β-Zel en an rekombinante, humane 125 Iod-GAD65-Enzyme des
Testkids. Danach zugegebenes, an Zel en gebundenes Protein A bindet an die
ermöglicht so ihre leichte Abtrennung durch Zentrifugation und anschließende
Bestimmung des Messignals mit Vergleich zu einer Standardreihe zur
Homocystein wurde durch Hochleistungschromatographie bestimmt
(Reagenzienkit Homocystein im Plasma, Chromsystems Instruments &
Chemicals GmbH, München, Deutschland).
Die Bestimmung des TSH erfolgte mittels des Analysegerätes Model ADVIA
Centaur ® und des dazugehörigen Reagenzienkits (Bayer Vital GmbH,
Geschäftbereich Diagnostics, Fernwald, Deutschland).
Die statistischen Maßzahlen wurden nach Beratung durch das Institut für
Computersoftware JMP 5.0 (SAS Institute Inc., Cary, North Carolina, USA)
Als deskriptive Lage- und Streuungsmaße werden Mittelwerte mit der
dazugehörigen Standardabweichung angegeben.
Eine Untersuchung auf Normalverteilung erfolgte mittels Shapiro-Wilk-Test auf
Normalverteilung, dabei wurde die Anpassung an die Normalverteilung ab 0,2 ≥
p ≥ 0,05 als schwach, bei p < 0,05 als fehlend definiert.
Die unifaktoriel e Analyse erfolgte durch einfache lineare Regressionsanalyse.
Bei al en Auswertungen waren die Anforderungen zur Durchführung einer
Regressionsanalyse
Korrelationskoeffizient nach Pearson, Gleichung der Regressionsgeraden, p-
Wert, 95%-Konfidenzinterval des Regressionskoeffizienten für x und r² als
Bestimmtheitsmaß.
Die multifaktoriel e Analyse wurde mittels multipler linearer Regressionsanalyse
durchgeführt. Al e Anforderungen zu ihrer Durchführung werden vom
vorliegenden Datensatz erfül t. Die eingehenden Größen wurden auf ihre
Unabhängigkeit und mögliche Wechselwirkungen untersucht. Angegeben
werden hierzu der adjustierte Regressionskoeffizient, dessen Standardfehler,
das entsprechende 95%-Konfidenzinterval , der p-Wert, die Anzahl der
Messwerte als n und zur Verdeutlichung der Aussagekraft des Model s das
Bestimmtheitsmaß R² und die Verteilung der Residuen.
3.1 Die Studienpopulation: Das untersuchte Kol ektiv (s.a. Tab. 3.1, 3.2) umfasste 172 Probanden. Dabei
handelte es sich um 104 Frauen und 65 Männer, deren Altersmittelwert 41,5
Jahren betrug, mit einer Standardabweichung (SD) von 12,4 Jahren. Davon
waren 23 Probanden aktive Raucher, al e anderen Probanden waren zum
Untersuchungszeitpunkt Nichtraucher.
Das Körpergewicht betrug im Mittel 82,3 kg ± 16,7 kg SD, die Körpergröße im
Mittel 170,9 cm ± 9,3 cm
SD was einen mittleren
BMI von 28,2 kg/m² ± 5,5
kg/m² SD entsprach (s.a.
Abb. 3.1). Die mittlere
waist-to-hip-ratio betrug
0,88 ± 0,09 bei einem
Körperfettanteil
Abbildung 3.1: Werteverteilung des BMI, grün= BMI≤25 bei n=52 Probanden entsprechen 42%; gelb= 25<BMI≤30 bei n=18 Probanden
30,5% ± 9,3% (s.a. Abb.
entsprechen 15%; rot=BMI≥30 bei n= 53 Probanden entsprechen 43%.
Im Rahmen eines oGTT
Körperfett >25%,
zuckerwerte von 90,5
mg/dl ± 9,5 mg/dl und
Nüchterninsulinwerte
von 55,4 pmol/l ± 34,4
Körperfett 15-25%,
pmol/l gemessen. 120
Körperfett <=15%,
Minuten nach Glukose-
belastung betrug der
Abbildung 3.2: Verteilung des prozentualen Körperfettgehalts,
grün=Körperfettgehalt ≤15% bei n=7 Probanden entsprechend 4%;
mitttlere Blutzucker 116
gelb=Körperfettgehalt 15-25% bei n=47 Probanden entsprechend 27%;
rot=Körperfettgehalt >25% bei n=118 Probanden entsprechend 69%.
mg/dl ± 30,8 mg/dl und
Plasmainsulin 427,5 pmol/l ± 394,9 pmol/l. Daraus errechnete sich ein mittlerer
ISI-Matsuda-Index von 16,4 ± 9,8 (Formel s. Kapitel 2.4). Der mittlere HbA1c lag mit 5,4% ± 0,4% im Normbereich.
weibl.Geschlecht
männl.Geschlecht
Körperfettanteil (%)
ISI-Matsudal-Index
BZ nüchtern (mg/dl)
BZ nach 120 Min. (mg/dl)
Insulin nüchtern (mmol/l)
Insulin nach 120 Min. (mmol/l)
Triglyceride (mg/dl)
Gesamtcholesterin (mg/dl)
Interleukin 6 (pg/dl)
diast. RR (mmHg)
Tabelle 3.1: Werteverteilung der Einflussgrößen, alle Angaben als Mittelwert ± Standardabweichung und Anzahl
der erhobenen Messwerte, Einheiten in Klammer, BZ=Blutzucker
Bei den gemessenen Blutfettwerten betrug das arithmetische Mittel der
Studienpopulation für Plasmatriglyceride 112,5 mg/dl ± SD von 66,6 mg/dl, für
das Gesamtcholesterin 189,8 mg/dl ± 30,6 mg/dl, für HDL-Cholesterin 55,5
mg/dl ± 14,0 mg/dl und für LDL-Cholesterin 119,3 mg/dl ± 26,9 mg/dl.
Es wurde für Leptin ein Mittelwert von 20,7 ng/dl ± 17,7 ng/ml gemessen, für
CRP betrug der Mittelwert 0,17 mg/dl ± 0,19 mg/dl, für TNF-α 4,1 pg/ml ± 8,1
pg/ml und für Interleukin 6 1,0 pg/ml ± 2,2 pg/ml.
Der mittlere Blutdruck nach Riva-Rocci lag bei 128 mmHg ± 16 mmHg
systolisch zu 81 mmHg ± 11 mmHg diastolisch.
Bei den untersuchten Zielgrößen (s.a. Tab. 3.2) zeigte sich ein mittlerer MCP-1-
Wert von 167,2 pg/ml ± 74,3 pg/ml. Die mittlere IMT der Gesamtpopulation war
0,54 mm ± 0,11 mm SD.
Standardabweichung
IMT linke A.carotis comm.(mm)
IMT rechte A.carotis comm.(mm)
mittlere IMT (mm)
Tabelle 3.2: Werteverteilung der Zielgrössen, alle Angaben als Mittelwerte ± Standardabweichung, alle hier
aufgeführten Messwerte waren für das gesamte Kollektiv von n=172 Probanden verfügbar.
Da unter al en Laborparametern nur das prozentuale Körperfett (Shapiro-Wilk-
Test auf Normalverteilung W=0,971, P=0,1940) und der HbA1c (Shaprio-Wilk W=0,977, P=0,8308), annähernd normalverteilt waren, wurden al e nicht
normalverteilten und rechtsschiefverteilten Messparameter zur weiteren
Analyse logarithmisch transformiert um sie besser an die Normalverteilung
anzunähern (s.a. Tab.3.3).
Die beide Zielgrößen MCP-1 (W=0,960, P=0,0013) und mittlere Intima-Media-
Dicke (Shapiro-Wilk W=0,988, P=0,5798) wurden von der Transformation
ausgenommen, um sie untereinander mit besserer Übersichtlichkeit vergleichen
Die Analyse der Einflussgrößen auf Abhängigkeiten untereinander ergab
verschiedene Komplexe an zusammenhängenden Messparametern:
Das weibliche Geschlecht war assozi ert mit hohem prozentualen
Körperfettanteil, niedrigem WHR und hohem Leptin.
In einem größeren Komplex korrelierten die anthropometrischen Messwerte für
Körpergewicht untereinander (s. Abb.3.3).
Shapiro-Wilk P-Wert vor Shapiro-Wilk
Nüchternblutzucker
120 Min Blutzucker
Nüchterninsulin
Gesamtcholesterin
Bludruck systol.
Blutdruck diastol.
Tabelle 3.3: Messwerteanalyse auf Normalverteilung; erkennbar wird die Annäherung an die Normalverteilung als
P-Werterhöhung nach Transformation. Ab P>0,1 bis 0,2 kann von ausreichender Anpassung an eine
Normalverteilung ausgegangen werden. Wo dies nicht vollständig erreicht wird, zeigt sich zumindest eine
Annäherung. Al e Angaben als Ergebnis des Shapiro-Wilk-Tests auf Normalverteilung, W= Testwert des Shapiro-
Wilk-Tests, vor log. Transform.= Testergebnis vor logarithmischer Transformation, nach log. Transform.=
Testergebnisse nach logarithmischer Transformation. Prozentualer Körperfettanteil (W=0,977 P=0,194) und HbA1c-
Werte (W=0,987 P=0,831) nicht aufgeführt, da annähernd normalverteilt.
Abbildung 3.3: Zusammenhänge zwischen den Übergewichtsmesswerten, r= Korrelationskoeffizient nach Pearson
Einen weiteren Komplex untereinander abhängiger Parameter stel ten die
Messwerte des Glukosestoffwechsels in Form der Blutzucker- und
Plasmainsulinmesswerte und der daraus errechnete ISI-Matsuda-Index dar.
Insbesondere für die Nüchtern- und postprandialen Insulinwerte fanden sich
auch Verbindungen zum BMI (s. Abb.3.4).
Abbildung 3.4: Zusammenhänge unter den oGTT-Messwerten und zwischen oGTT-Messwerten und dem BMI, r=
Korrelationskoeffizient nach Pearson
Auch die Blutfettwerte standen untereinander in Verbindung. Dabei korrelierte
Gesamtcholesterin mit LDL-Cholesterin (r=0,83). Hohes Leptin zeigte
Assoziation zum weiblichen Geschlecht, zu erhöhtem BMI (r=0,59) und eine
starke Verbindung zum hohen prozentualen Körperfett (r=0,85).
Ferner korrelierten systolischer und diastolischer Blutdruck untereinander
Auf Grund dieser engen Zusammenhänge der Messgrößen untereinander
wurden bei Korrelationen von r>±0,60 nicht al e der so zusammenhängenden
Messparameter in den multivariaten Analysen berücksichtigt.
3.2 Einflusskaktoren auf die Intima-Media-Dicke:
a) Unifaktoriel e Analyse der Intima-Media-Dicke:
Die Intima-Media-Dicke stand bivariat in Verbindung mit dem Pobandenalter
(s.a. Abb.3.5) und dem Probandengeschlecht. Hierbei zeigten Männer eine
signifikant höhere IMT (s.a. Tab. 3.4).
Hohe IMT korrelierte auch signifikant mit erhöhtem Körpergewicht, hohem BMI,
hohem WHR, aber nicht mit hohem prozentualem Köperfettanteil.
Es fand sich eine Verbreiterung der IMT bei höheren Werten für
Nüchternblutzucker und 120-Minuten-Blutzucker. Nüchterninsulin und 120-
Minuteninsulin verfehlten knapp das Signifikanzniveau. Es fanden sich ferner
die Verbindung zum ISI-Matsuda-Index, der sich aus den oben genannten
oGTT-Messwerten errechnet, und außerdem zum HbA1C: auch hier waren Insulinresistenz beziehungsweise höhere HbA1C-Werte mit einer erhöhten IMT verbunden.
4 4,1 4,3 4,5 4,7
Abbildung 3.5: Korrelation mittlere IMT (in mm) zu Alter (in Jahren) und IMT (in mm) zu HDL (in mg/dl), ln HDL= nach
logarithmischer Transformation, r= Korrelationskoeffizient nach Pearson, P= Signifikanzniveau
Die Blutfettwerte der Triglyceride, des LDL-Cholesterins und des
Gesamtcholesterins zeigten keine ausgeprägte Korrelation mit der IMT. Jedoch
zeigte sich eine Beziehung zum HDL-Cholesterin, dessen Erhöhung mit einer
erniedrigten IMT assozi ert war (s.a. Abb.3.5).
Während kein Zusammenhang der IMT mit Leptin (r=0,04, P=0,61), CPR oder
TNF-α bestand, fand sich ein signifikanter Zusammenhang mit IL-6. Ein höherer
IL-6-Spiegel war mit erhöhter IMT assozi ert. Eine solche Verbindung bestand
auch zwischen der IMT und dem systolischen Blutdruck, jedoch nicht zum
diastolischen Blutdruck. Die IMT wurde in unseren Daten durch aktives
Rauchverhalten der Probanden nicht beeinflusst (P=0,2551).
Auch zwischen den beiden Zielgrößen der Studie, IMT und MCP-1 bestand eine
univariat signifikante, positive Korrelation. Eine MCP-1-Erhöhung ging hier mit
einer höheren IMT einher (s.a. Abb. 3.6).
Abbildung 3.6: Korrelation der einfachen linearen Regressionsanalyse für MCP-1 (in pg/ml) zu
IMT (in mm), r= Korrelationskoeffizient nach Pearson, P= Signfikanzniveau
intervall des Signifikanz
P=0,0171 0,03 n=172
r=0,6210 0,32+0,0054·Alter
P<0,0001 0,39 n=172
Körpergewicht r=0,3070
P<0,0001 0,09 n=172
-0,05+0,0178·ln
P<0,0001 0,09 n=172
P<0,0001 0,19 n=171
P<0,0001 0,14 n=172
0,35+0,104·ln 120
P=0,0009 0,06 n=172
0,64-0,036·ln ISI -0,06 bis -0,01 P=0,0058 0,04 n=172
r=0,3027 0,11+0,080·HbA1c
P<0,0001 0,09 n=172
-0,15 bis -0,01 P=0,0209 0,03 n=172
P=0,0003 0,08 n=163
-0,35+0,1859·ln
P=0,0166 0,04 n=142
P=0,0447 0,02 n=172
Tabelle 3.4: Signifikante Korrelationen der einfachen, linearen Regressionsanalyse für IMT, alle Angaben zeigen
die Korrelationskoeffizienten nach Pearson, Gleichung der Regressionsgeraden, 95%-Konfidenzinterval des
Regressionskoeffizienten für x, r² und Anzahl der Messwerte der jeweiligen Größe, ln= Analyse wurde mit
logarithmisch transformiertem Wert durchgeführt, n= Anzahl der vorhandenen Messwerte des jeweiligen
Einfluss auf IMT
prozent.Körperfett r=0,3367
ln Nüchterninsulin r=0,1381
r=0,1065 0,44+0,0228·ln Tg -0,009 bis 0,55
Gesamtcholesterin
ln LDL-Cholesterin r=0,0293 0,47+0,014·ln LDL -0,06 bis 0,09
0,01+0,12·ln RR
Tabelle 3.5: Nicht signifikante Korrelationen der einfachen, linearen Regressionsanalyse für mittlere IMT, alle
Angaben zeigen die Korrelationskoeffizienten nach Pearson, Gleichung der Regressionsgeraden, 95%-
Konfidenzintervall des Regressionskoeffizienten für x, r² und Anzahl der Messwerte der jeweiligen Größe,, n.s.= nicht
signifikant ab einem Signifikanzniveau von über P>0,05, ln= Analyse wurde mit logarithmisch transformiertem Wert
durchgeführt, n= Anzahl der vorhandenen Messwerte des jeweiligen Messparameters, Korell.koeff.=
Korrelationskoeffizient
b) Multifaktoriel e Analyse der Intima-Media-Dicke:
Die multifaktoriel e Analyse erfolgte als multiple, lineare Regressionsanalyse.
Es wurden unifaktoriel signifikante Messgrößen mit einem Zusammenhang von
P<0,1 im statistischen Model aufgenommen (s.a. Tabel e 3.4), soweit keine
vorbeschrieben bestanden.
In das multifaktoriel e Model fanden Probandengeschlecht, Probandenalter,
BMI, ISI-Matsuda, HbA1c, HDL-Cholesterin, Interleukin 6, systolischer Blutdruck und MCP-1 Eingang.
3,3 3,5 3,7 3,9 4,1 4,3 4,5 4,7
Age Leverage, P<.0001
ln HDL Leverage, P=0,0235
Abbildung 3.7: Punktwolken der berücksichtigen Probanden für das Alter (in Jahren) und das HDL (in pg/ml), ln
HDL= HDL nach logarithmischer Transformation, ins Modell waren eingegangen: Geschlecht, Alter, BMI, ISI-
Matsuda, HbA1c, HDL, IL-6, syst.RR, MCP-1
Für die Intima-Media-Dicke (s.a. Tab. 3.6) zeigten sich das Probandenalter und
das HDL-Cholesterin als unabhängige, signifikante Einflussgrößen. Während
die IMT mit dem Alter steigende Tendenz zeigte, hatte HDL-Cholesterin einen
protektiven Einfluss auf die IMT (s.a. Abb. 3.7).
Hohe MCP-1-Plasmaspiegel
signifikant niedrigeren IMT
assozi ert (s.a. Abb. 3.8).
Das IL-6 verfehlte mit einem
P=0,0585 knapp die Grenze
(s.a. Abb. 3.9). Al e anderen
berücksichtigten Messgrößen
MCP-1 Leverage, P=0,0233
erreichten ebenfal s nicht die
nötige Signifikanz und hatten
Abbildung 3.8: Punktwolke der im statistischen Modell für IMT
berücksichtigten MCP-1-Messwert, MCP-1 (in pg/ml), P= p-Wert,
somit keinen unabhängigen
ins Modell waren eingegangen: Geschlecht, Alter, BMI, ISI-
Matsuda, HbA1c, HDL, IL-6, syst.RR, MCP-1
Einfluss auf die IMT.
-koeffizient abweichung Konfidenzintervall
-0,0258 bis 0,0083
0,0044 bis 0,0072
-0,0272 bis 0,1909
-0,0182 bis 0,0412
-0,0459 bis 0,0357
-0,1599 bis -0,0125
-0,0004 bis 0,0334
ln systolischer RR
-0,0824 bis 0,1735
-0,0000438 bis -0,00034
Tabelle 3.6: Ergebnisse der multiplen linearen Regression für mittlere IMT unter Berücksichtigung al er univariat
signifikanten Parameter mit P<0,1, Angaben als Regressionskoeffizient, Standardabweichung, 95%-
Konfidenzintervall und P-Wert, ln= Messwert wurde logarithmisch transformiert. n.s.= nicht signifikant ab einem
0,4 0,5 0,6 0,7 0,8 0,9 1,0
ln Il-6 Leverage, P=0,0585
mittlere IMT Predicted
Abb.3.9: Punktwolke der im Modell berücksichtigten IL-
6-Messwerte; IL-6 in pg/ml, ln IL-6=nach logarithmischer
Abb.3.10: Punktwolke der nicht berücksichtigeten IMT-
Transformation, ins Modell waren eingegangen:
Werte; ins Modell waren eingegangen: Geschlecht,
Geschlecht, Alter, BMI, ISI-Matsuda, HbA1c, HDL, IL-6,
Alter, BMI, ISI-Matsuda, HbA1c, HDL, IL-6, syst.RR,
Auch bei Berücksichtigung des prozentualen Körperfettanteils oder des WHR
anstatt des BMI veränderten sich die Ergebnisse des Model s nicht wesentlich.
In dieser Analyse wurden n=139 Probandendatensätze integriert. Das
statistische Model hatte mit R²=0,4974 eine ausreichend hohe Aussagekraft.
Es erklärte über 49% der Varianz der mittleren Intima-Media-Dicke. Ferner
zeigten seine Residuen, die Differenz zwischen geschätzten und beobachteten
IMT-Werten, (s.a. Abb. 3.10) nach Abschätzung mittels Shapiro-Wilk-Test mit
W=0,9790, P=0,3711 eine gute Normalverteilung als weiteres Gütekriterium der
Model anpassung.
3.3 Einflussfaktoren auf den MCP-1-Plasmaspiegel:
a) Unifaktoriel e Analyse des MCP-1:
MCP-1 stieg signifikant mit älterem
Probandenalter an. Es war aber nicht
mit dem Geschlecht assozi ert.
Übergewicht war es verbunden mit
Körpergewicht, BMI, WHR und
prozentualen Körperfettanteil (s.a.
Abb. 3.11). Übergewichtigkeit und
Prozent. Körperfett
viszerale Adipositas ist mit erhöhtem
MCP-1 im Plasma assozi ert.
Abbildung 3.11: Einfache, lineare Regression des MCP-
Die Chemokinkonzentration stieg
1 (in pg/ml) zu prozentualem Körperfett (in %), r=
Korrelationskoeffizient nach Pearson, P=
Signifikanzniveau
Messgrößen des oGTT deutlich mit
höherem 120-Minutenblutzucker, 120-Minuteninsulin und höherem ISI-
Matsuda, aber kaum bei höherem Nüchternblutzucker und Nüchterninsulin.
Dazu passend zeigten sich höhere MCP-1-Spiegel bei hohen HbA1c-Werten. Bei den Blutfettwerten fanden sich deutlich signifikante, positive Korrelationen
des Chemokins mit Triglyceriden und negative Korrelationen zum HDL-
Cholesterin (s.a. Abb. 3.12). Keinerlei Zusammenhänge zeigten sich jedoch
zwischen Gesamtcholesterin und LDL-Cholesterin mit MCP-1.
4 4,1 4,3 4,5 4,7
Abbildung 3.12: Einfache, lineare Regression des MCP-1 (in pg/ml) zu Plasmatriglyceriden (in mg/dl)
beziehungsweise HDL-Cholesterol (in mg/dl), ln= Triglyceride und HDL nach logarithmischer Transformation, r=
Korrelationskoeffizient nach Pearson, P= Signifikanzniveau
Einfluss auf Korrel.-
Regressionsgeraden,
koeffizienten für x
Nüchternblut r=0,1283
Gesamtchol- r=0,0826
-1,77+35,5·ln LDL
165,34-1,0·ln CRP
170,49-4,9·ln TNF-α
171,84+9,2·ln IL-6
-197,98+85,5·ln diast.
Tabelle 3.7: Nicht signifikante Korrelationen der einfachen, linearen Regressionsanalyse für MCP-1, al e Angaben
zeigen die Korrelationskoeffizienten nach Pearson, Gleichung der Regressionsgeraden, 95%-Konfidenzintervall des
Regressionskoeffizienten für x, r² und Anzahl der Messwerte jeweilige Größe, n.s.= nicht signifikant ab einem
Signifikanzniveau von P>0,05, ln= Analyse wurde mit logarithmisch transformiertem Wert durchgeführt, n= Anzahl
vorhandene Messwerte jeweiliger Messparameter, Korell.Koeff.= Korrelatiosnkoeffizient
Es zeigten sich ebenfal s gewisse Verbindungen von Leptin zu MCP-1 mit
erhöhten Spiegeln bei hohem Leptin, aber keine Assoziation zu CRP, TNF-α
oder Interleukin-6.
Auch erhöhte systolische Blutdruckwerte sind mit MCP-1 positiv korreliert,
während der diastolische Blutdruck das Chemokin nicht beeinflusste. Zum
aktiven Rauchverhalten zeigte sich kein erkennbarer Zusammenhang.
geraden, MCP-1= koeffizienten
r= 0,3306 85,15+1,98·Alter
1,12 bis 2,83 P<0,0001 0,11 n=172
0,63 bis 1,92 P<0,0001 0,09 n=172
-324,49+148,04·ln
91,8 bis 204,2 P<0,0001 0,14 n=172
45,6 bis 259,7 P=0,0055 0,04 n=171
1,17 bis 3,48 P<0,0001 0,09 n=172
21,8 bis 104,9 P=0,0030 0,05 n=172
2,47 bis 29,46 P=0,0207 0,03 n=172
228,61-23,57·ln
-40,7 bis -6,4 P=0,0073 0,04 n=172
r=0,2098 -37,0+37,8·HbA1c 11,1 bis 64,4 P=0,0057 0,04 n=172
-23,8+41,6·ln TG
20,5 bis 62,8 P=0,0001 0,08 n=172
r= -0,1725 380,2-53,4·ln HDL
P=0,0236 0,03 n=172
P=0,0023 0,07 n=141
-340,0+106,5·ln
systolischer r= 0,1728
5,1 bis 208,0 P=0,0397 0,03 n=142
Tabelle 3.8: Signifikante Korrelationen der einfachen, linearen Regressionsanalyse für MCP-1 alle Angaben
zeigen die Korrelationskoeffizienten nach Pearson, Gleichung der Regressionsgeraden, 95%-Konfidenzintervall
des Regressionskoeffizienten für x, r² und Anzahl der Messwerte der jeweiligen Größe, ln= Analyse wurde mit
logarithmisch transformiertem Wert durchgeführt, n= Anzahl der vorhandenen Messwerte des jeweiligen
Messparameters, 95%-Konf.Intervall= 95%-Konfidenzintervall, Korell.koeff.=Korrelationskoeffizient
b) Multifaktoriel e Analyse auf Einflussfaktoren des MCP-1:
In dieses Model fanden die unifaktoriel für
MCP-1 signifikanten Größen mit P<0,1
Eingang und zusätzlich LDL-Cholesterin,
Berücksichtigung
eventuel er Dyslipidämien.
Übergewichtsmaß
prozentuale Körperfettanteil verwendet.
Alter Leverage, P=0,0125
Abbildung 3.13: Punktwolke der im Modell
Dieser zeigte einen engen Zusammenhang
berücksichtigten Altersangaben, Alter in Jahre, P= Signifikanzniveau, ins Modell eingegangen:
mit dem BMI, was den Einschluss nur einer
Geschlecht, Alter, prozent.Körperfett, ISI-
Matsuda, HbA1c, Triglyceride, HDL, LDL,
der beiden Größen in das statistische
Model nahe legte.
Damit wurden Geschlecht, Alter, prozentualer Körperfettanteil, ISI-Matsuda-
Index, HbA1c, Plasmatriglyceridspiegel, HDL-Cholesterinspiegel, LDL-Cholesterinspiegel und systolischer Blutdruck ins Model aufgenommen.
Als Ergebnis der multiplen linearen Regressionsanalyse blieb das
Probandenalter als signifikante,
unabhängige Einflussgrößen für
MCP-1-Konzentration
Blutplasma (s.a. Tab. 3.9). Dabei
wiesen ältere Probanden höhere
MCP-1-Spiegel auf (s.a. Abb.
3.13). Außerdem gingen hohe
Plasmakonzentrationen
Prozent. Körperfett Leverage,P=0,0086
Triglyceriden und ein hoher
prozentualer Körperfettanteil mit
Abbildung 3.14: Punktwolken der im Modell für MCP-1 (in
mg/dl) berücksichtigen Messwerten für das prozentuale
Körperfett (in %), P= Signifikanzniveau, ins Modell
eingegangen: Geschlecht, Alter, prozent.Körperfett, ISI-
Konzentrationen einher (s.a. Abb.
Matsuda, HbA1c, Triglyceride, HDL, LDL, syst.RR.
3.14 und Abb. 3.15).
0,3211 – 2,5243
prozent. Körperfett
0,7502 – 4,9066
-65,12 – 55,25
ln systolischer RR
-81,88 – 127,02
Tabelle 3.9: Ergebnisse der multiplen linearen Regressionsanalyse für MCP-1 unter Berücksichtigung aller univariat
signifikanten Einflüsse mit P<0,1 und LDL, ln= Wert nach logarithmischer Transformation, n.s.= nicht signifikant ab
3,0 3,5 4,0 4,5 5,0 5,5 6,0
ln Triglyceride Leverage, P=0,0074
Abbildung 3.15: Punktwolken der im Modell für MCP-1
(in mg/dl) berücksichtigen Messwerten für das
Plasmatriglyceridlevel (in mg/dl), ln= letzteres nach
Abbildung 3.16: Dargestellt ist die Punktwolke der
logarithmischer Transformation, P= Signifikanzniveau,
Residuen des Models, ins Modell eingegangen:
ins Modell eingegangen: Geschlecht, Alter,
Geschlecht, Alter, prozent.Körperfett, ISI-Matsuda,
prozent.Körperfett, ISI-Matsuda, HbA1c, Triglyceride,
HDL, LDL, syst.RR.
1c, Triglyceride, HDL, LDL, syst.RR
Wenn statt dem prozentualen Körperfettanteil der BMI im Model berücksichtigt
wurde, blieben al e beschriebenen signifikanten Beziehungen in ähnlicher
Stärke messbar. Neue Zusammenhänge mit weiteren Messgrößen zeigten sich
dabei nicht. Die WHR erreichte, wenn sie den BMI im Model ersetzte, nicht das
geforderte Signifikanzniveau (P=0,3939) eines unabhängigen Einflussfaktors.
Das Programm berücksichtigte in diesem Model n=142 Probandendatensätze.
Es erklärte mit R²=0,212 mehr als 21% der Varianz des MCP-1 im
Probandenplasma. Die Verteilung der Residuen (s.a. Abb. 3.16) zeigte nach
Shapiro-Wilk eine sehr gute Annäherung an die Normalverteilung (W=0,988,
P=0,8886) und sprach für die Qualität des Model s.
c) Zweites Model für MCP-1:
Um die Herkunft des gemessenen MCP-1 im Plasma noch genauer zu
untersuchen und um indirekte Induktionsmechanismen vor al em durch Leptin
auszuschließen, über die bei Fettleibigkeit das Fettgewebe die MCP-1-
Konzentration im Plasma erhöhen könnte, wurden zusätzliche Untersuchungen
an einem getrennten, zweiten Model für MCP-1-Einflüsse durchgeführt.
Hier gingen die unifaktoriel für MCP-1
signifikanten Variablen Geschlecht, Alter,
prozentualer Körperfettanteil, die Plasma-
konzentrationen der Triglyceride, des HDL-
-1 Leverage RP 100
Cholesterin und von Leptin ein. Außerdem
ln Leptin Leverage, P=0,8609
signifikante LDL-Cholesterin aufgenommen.
Abbildung 3.17: Punktwolken der bei der
multiplen linearen Regressionsanalyse zur
Es zeigten sich in dieser multiplen, linearen
MCP-1-Beeinflussung berücksichtigen
Messwerte für Leptin im Probandenplasma (in
Regressionsanalyse (s.a. Tab. 3.10) neben
ng/ml), ln= nach logarithmischer
Transformation zur Annäherung an die
Normalverteilung, P= Signifikantniveau im
statistischen Modell, ins Modell eingegangen:
Geschlecht, Alter, prozent.Körperfett,
Körperfettgehalt
Triglyceride, HDL, LDL, Leptin.
Plasmatriglyceridlevel (s.a. Abb.3.18) als unabhängige Einflussfaktoren für
MCP-1. Leptin erreichte nicht das Signifikanzniveau für einen unabhängigen
Einflussfaktor von P<0,05 (s.a. Abb. 3.17). Ebensowenig taten dies HDL- und
LDL-Cholesterin (s.a. Tab. 3.10).
-1 Leverage RP 100
-1 Leverage R 100
Prozent. Körperfett Leverage,
3,0 3,5 4,0 4,5 5,0 5,5 6,0
ln Triglyceride Leverage, P=0,0328
Abbildung 3.18: Punktwolken der bei der multiplen linearen Regressionsanalyse zur MCP-1-Beeinflussung
berücksichtigen Messwerte für prozentuales Körperfett (in %) und Plasmatriglyceridlevel (in mg/dl), ln= beide
nach logarithmischer Transformation zur Annäherung an die Normalverteilung, P= Signifikantniveau im
statistischen Modell, ins Modell eingegangen: Geschlecht, Alter, prozent.Körperfett, Triglyceride, HDL, LDL,
0,7317 – 2,5202
prozent. Körperfett
0,03723 – 4,6617
-81,26 – 22,46
-73,81 – 36,28
Tabelle 3.10: Ergebnis der multiplen linearen Regressionsanalyse für MCP-1 unter Berücksichtigung spezieller
Faktoren, ln= nach logarithmischer Transformation zur Annäherung an die Normalverteilung, n.s. =nicht
signifikant ab einem Signifikanzniveau von P>0,05.
Das Model erklärte mit R²=0,2870
unter Berücksichtigung von n=141
Probandendaten beinahe 29% der
Varianz des MCP-1-Plasmalevels bei
al erdings schlechterer Anpassung der
Residuen an die Normalverteilung
50 100 150 200 250 300 350 400
(Shapiro-Wilk W=0,945 P<0,0001, s.a.
Abbildung 3.19: Punktwolke der Residuen der
multiplen linearen Regressionsanalyse für MCP-1
unter Berücksichtigung spezieller Faktoren, ins
Modell eingegangen: Geschlecht, Alter,
prozent.Körperfett, Triglyceride, HDL, LDL, Leptin.
_4. Diskussion _
4.1 Zusammenfassung der Ergebnisse:
Die IMT zeigte eine signifikante Korrelation (nach Pearson) zum Lebensalter,
BMI, WHR, systolischer Blutdruck, Blutzucker, HbA1c, ISI, HDL-Cholesterin, IL-
6 und MCP-1. Nicht signifikant in unserem Prädiabetikerkol ektiv hingegen
waren diastolischer Blutdruck, LDL-Cholesterin, Triglyceride, Leptin, hsCRP
und TNF-α. In der multifaktoriel en Analyse (multiple lineare Regression) unter
Einschluss der univariat signifikanten Variablen, waren lediglich Alter, HDL-
Cholesterin und MCP-1-Spiegel von relevanter Bedeutung. Hier zeigten sich
al erdings höhere MCP-1-Spiegel mit einer niedrigeren IMT assozi ert. Die
Betrachtung von welchen Faktoren die löslichen MCP-1-Spiegel primär
abhängen zeigte das Lebensalter, die prozentuale Körperfettmasse und die
Serum-Triglyceride von signifikanter Bedeutung.
4.2 Besonderheiten der Probandengruppe:
Es handelte sich um ein relativ junges Kol ektiv (Altersmittelwert 41,5 ± 12,4
Jahre) bei dem durch die Auswahlkriterien der Einfluss isolierter, stark
ausgeprägter, kardiovaskulärer Risikofaktoren bewußt ausgeschlossen wurde.
Dazu zählten stark erhöhtes Cholesterin im Plasma, eine höhergradige
arteriel e Hypertonie, eine gestörte Glukosetoleranz beziehungsweise Diabetes,
und eine Hyperhomocysteinämie. Es wurden außerdem Probanden mit
nachweislich stärkeren, inflammatorischen Prozessen, zum Beispiel infektiöser
Genese, ab einem CRP > 1,0 mg/dl ausgeschlossen. Der Anteil aktiver
Raucher war mit 13,4% sehr gering. Auch Schilddrüsenfunktionsstörungen mit
ihrem bekannten Einfluss auf zahlreiche metabolische Faktoren werden
Der MCP-1-Mittelwert von 167,2 ± 72,3 ng/ml überstieg den Wertebereich von
73,6 ± 5,9 ng/ml, wie er von gesunden Kol ektiven berichtet wurde (72). Er
erreichte aber andererseits nicht den hohen Wertebereich von über 300 ng/ml
eines Patienten mit manifester KHK oder peripherer Verschlusskrankheit (43,
_4. Diskussion _
48). Dies veranschaulicht eventuel das intermediäre Risiko von sogenannten
„Prädiabetikern" wie in unserem Kol ektiv untersucht.
Da im vorliegenden Kol ektiv hohes Körpergewicht beziehungsweise
Übergewicht in Form des BMI > 27 kg/m2 eines der Einschlusskriterien
darstel te und so gezielt eine adipöse Population geschaffen wurde, ergab sich
eine hohe Prävalenz von Adipositas und Übergewicht im untersuchten
Probandenkol ektiv (über 50% der Probanden hatten einen BMI > 27 kg/m²,
über 69% hatten einen prozentualen Körperfettanteil von > 25%, (s.a. Abb. 3.1
und 3.2). Als Folge fand sich damit überproportional häufige eine Dyslipidämie.
Die Diät ist eine relevante Einflussgröße auf die Lipoproteinspiegel (28, 40). So
erhöht die Aufnahme tierischer Fette und Proteine und eine bewegungsarme
Lebensweise den Plasmaspiegel proatherogener Lipoproteine (40).
Eine weitere wichtige Rol e für die Blutfette spielt das Übergewicht in Form
eines BMI > 25 kg/m² und Fettleibigkeit als BMI > 30 kg/m², die beide
unabhängige Assoziationen zu hohen Triglyceridspiegeln im Plasma und zu
gesenkten HDL-Werten zeigten (3, 16, 28). Bei Gewichtsreduktion unter einen
BMI < 25 kg/m² zeigen sich deutliche Besserungen beider genannten
Blutfettwerte (28). Speziel bei abdominaler Fettleibigkeit finden sich ebenfal s
die beschriebenen, unabhängigen Verbindungen (16, 17).
Die Kombination aus kleinen, dichten LDL, erhöhten triglyceridreichen
Lipoproteinen und ihren Remnants und der HDL-Abnahme stel t ein eigenes
Muster einer atherogenen Dyslipidämie neben den bekannten, erhöhten LDL-
Werten dar und wird „Dyslipidemic Triad" genannt (50). Diese mit Fettleibigkeit
assozi erte Dyslipidämie (50, 66) steht oft vor dem Hintergrund eines
metabolischen Syndroms (40, 66), zum Beispiel über eine erhöhte Produktion
von VLDL-apoB100, vermindertem Abbau apoB-enthaltender Lipoproteine und
verstärkter Metabolisierung von HDL-apoA-I-Partikeln (17).
Damit findet sich bei Fettleibigkeit oder Übergewicht (17, 75) und
Insulinresistenz (75) gehäuft eine typische, atherogene Dyslipidämie (17, 75)
mit hohen Triglycerid- und niedrigen HDL-Werten (17, 28, 66).
_4. Diskussion _
Dies spricht dafür, dass sich unter den vorliegenden Probanden ein starker
Einfluss der Fettmasse und der durch sie verursachten atherogenen
kardiovaskulärer Risikofaktoren im untersuchten, jungen und gesunden
Kol ektiv eher unterrepräsentiert und schwach ausgeprägt sind; wie isoliert
erhöhtes LDL-Cholesterin (LDL-Cholesterinmittelwert unseres Kol ektivs 119,32
± 26,92 mg/dl) oder Hypertonus (Mittlere Blutdruckwerte unseres Kol ektives:
128 ± 16 mmHg systolisch zu 81 ± 11 mmHg diastolisch).
4.3 Fettgewebe und MCP-1 im Plasma:
Der von uns beschriebene, unabhängige Zusammenhang zwischen
prozentualem Körperfettgehalt und dem MCP-1-Plasmaspiegel spricht für einen
selbständigen, direkten Einfluss von Fettleibigkeit auf das Chemokin.
In der Literatur wurde ein solcher Zusammenhang mit dem Körpergewicht von
Mäusen beschrieben (112) und auch am Menschen wurde er mit dem BMI als
Messparameter des Übergewichts gefunden (19).
Durch das Übergewicht und der damit assozi erten Erhöhung der Fettmasse
werden die Triglyceride im Plasma erhöht. Doch diese stel ten neben dem
prozentualen Körperfettanteil einen eigenen, unabhängigen Einflussfaktor dar,
der später noch genauer besprochen wird. Es muss also weitere Mechanismen
geben, wie Fettgewebe triglyceridunabhängig die MCP-1-Plasmaspiegel
erhöhen kann. Eine Möglichkeit ist, dass Fettgewebe selbst MCP-1 ins Plasma
Fettgewebe ist, wie bereits erwähnt, mehr als ein reiner Fettspeicher (67).
Vielmehr ist es metabolisch hock aktiv (16, 67), endokrin und parakrin
sezernierend (71) und als solch endokrines Organ, nach dem lymphatischen
Gewebe, der größte Produzent von Signalmolekülen im menschlichen Körper
(69, 112). Es produziert Leptin (67, 69), TNF-α (17, 69, 83), Interleukin 6 (7,
17), Interleukin 8 (19), Interleukin 1 (38), PAI-1 (17, 67), Angiotensinogen (67,
69) und Adiponektin (16). Unter diesen Adipokinen finden sich neben
_4. Diskussion _
Proteasen, Proteaseninhibitoren und Hormonen (67) auch Wachstumsfaktoren
(13, 67) und weitere proinflammatorische Zytokine (13, 67, 112). Sie bewirken
neben der Kontrol e der Fettzel funktion (38) und der Beeinflussung der
Insulinwirkung (69) die Vermittlung einer niedriggradigen, eventuel auch
vaskulären Inflammation (19, 69). Diese sezernierten Proteine spielen
möglicherweise für das kardiovaskuläre Risiko das mit Übergewicht assozi ert
ist eine Rol e (69, 83).
Versuche sowohl an Kulturen von Präadipozyten und differenzierten Adipozyten
des menschlichen, subkutanen Bauchfettes zeigen neben Interleukin 8 auch
eine Produktion und Sekretion von MCP-1 (38). Bei der Differenzierung vom
Präadipozyten zum reifen Adipozyten fäl t im Überstand der Kultur die MCP-1-
Konzentration um 27%, ist aber weiterhin nachweisbar (38). TNF-α-Stimulation
reifer Adipozyten erhöht wiederum die MCP-1-Produktion und auch die von
TNF-α selbst (38). Die Chemokinkonzentration im Überstand der Kultur
entspricht der im Plasma leukämischer Patienten oder wie sie bei Sepsis
gefunden wird (38). Dies spricht für die physiologische Relevanz der
gefundenen Produktion.
Eine andere Studie findet in Kulturen von menschlichen Fettzel en aus
Fettabsaugung einen MCP-1-mRNA-Gehalt, der 17% des MCP-1-mRNA-
Gehalts von Gefäßwandzel en entspricht (19). Mehr noch, der individuel e MCP-
Plasmakonzentration im Kreislauf des jeweiligen Spenders und außerdem mit
dessen BMI (79). Eine 12-prozentige Körpergewichtsreduktion im Rahmen
Lifestyleintervention
Konzentrationsreduktion im Probandenplasma (19).
Tierversuche an übergewichtigen Mäusen zeigten, dass dort MCP-1
überexprimiert wird und weißes Fettgewebe seine Hauptquel e darstel t (101).
Vergleiche der Expression von 12000 Genen in weißem Fettgewebe von
normalgewichtigen und fettleibigen Mäusen zeigen an letzteren eine 7x erhöhte
MCP-1-Produktion im Vergleich zu normalgewichtigen Individuen (112). Sowohl
_4. Diskussion _
in den Fettzel en als auch im Blutplasma zeigte sich das MCP-1 erhöht, was
dafür spricht, dass die MCP-1-mRNA-Veränderungen der Fettzel en den
Plasmaspiegel des Chemokins im Verhältnis zum Körpergewicht verändern
(112). Bestätigt wurde diese Vermutung, durch den Verlauf der Änderungen der
MCP-1-Plasmakonzentration, die paral el zu Körpergewichtszunahme ansteigt
und bei Nahrungskarenz mit dem Körpergewicht wieder abfäl t (112). Al diese
Funde sprechen stark für einen kausalen Zusammenhang zwischen Adipositas
und dem MCP-1-Plasmaspiegel (112).
Damit stel t das Fettgewebe, neben der atherosklerotischen Läsion, eine zweite
Quel e für MCP-1-Proteine im Blutplasma dar. Sie erklärt die unabhängige
Verbindung der Plasmakonzentration des MCP-1 zum prozentualen
Körperfettgehalt im von uns untersuchten Probandenkol ektiv. Die hohe
Prävalenz der Fettleibigkeit in der vorliegenden Probandengruppe bei
Abwesenheit anderer gravierender Einflüsse erklären, warum ausgerechnet
diese Beziehung im untersuchten Kol ektiv wie erwartet so stark zur Geltung
Durch Fettgewebesekretion erhöhte MCP-1-Plasmaspiegel könnten in Form
Neointimaentwicklung
Monozytenrekrutierung atherosklerosefördernde Folgen haben (19, 112). Im
von uns untersuchten Kol ektiv scheint sich dies aber nicht zu bestätigen.
4.4 MCP-1-Plasmaspiegel Intima-Media-Dicke:
Die multivariate Analyse der Einflussfaktoren auf die IMT ergab den MCP-1-
Blutplasmaspiegel als möglichen, schützenden Einflussfaktor. Mit höheren
MCP-1-Werten fiel die Intima-Media-Dicke ab.
Eine mögliche Erklärung hierfür liefert die Betrachtung des MCP-1-
Wirkungsmechnismus bei der Atheroskleroseauslösung:
Physiologisch machen Leukozyten Selektin-vermitteltes Rol ing entlang des
vaskulären Endothels bis sie auf hohe, lokale Konzentration von Chemokinen
_4. Diskussion _
stoßen, die ihnen auf Oberflächenmolekülen oder lokal membrangebunden
präsentiert werden (91). Dies führt zu einer Erhöhung der Integrinaffinität, was
Leukodiapedese zur Folge hat (91). Die extravasalen Leukozyten folgen dann
der Chemokinkonzentration bis zu ihrem Maximum (91).
Bei einer lokalen Entzündungsreaktion wird an diesem Ort die Wirkung der
Chemokine auf chemokin-sensitive Zel en zum Auslöser der starken Adhäsion
der bis dahin rol enden Leukozyten am Endothel. Nach Diapedese werden die
Zel en vom Chemokingradienten zu der Inflammationsstel e geleitet (91).
MCP-1 vermittelt die Rekrutierung von Makrophagen (11) und anderen
Leukozyten (44) in den Atheroskleroseherd (11, 25) und bewirkt mit diesem
entzündlichen Prozess (25, 44, 64) eines der frühesten Ereignisse der
Atheroskleroseentwicklung (11, 92, 130). Nach der inflammatorischen
Aktivierung durch Endothelverletzung ergibt sich durch MCP-1 eine positive
Feedback-Schleife zwischen vaskulärer Inflammation und Aktivierung läsionaler
Monozyten (32). Diese Inflammation, mit Einbeziehung verschiedener Faktoren
wie Adhäsionsmoleküle, Cytokine und Chemokine, spielt eine zentrale Rol e bei
Atherosklereose und Restenose (32, 112, 114).
Mit der Migration von glatten Muskelzel en löst das Chemokin einen weiteren
Pathomechnismus der Atherosklerose aus (58, 85, 103).
Diese zentrale Wirkung wird durch Tierversuche bestätigt: So bewirkt ein Block
der MCP-1-Wirkung am Model von Knockout-Mäusen (56, 93, 108) oder der
gelungene Versuch einer Gentherapie mit einem hemmenden MCP-1-Mutant
(32) eine Reduktion der Atherosklerose (32, 56, 108) beziehungsweise eine
Stabilisierung des Plaques und reduzierte Chemokinspiegel im Blut (93).
Im Tierversuch ist die Expression von MCP-1 und seines Rezeptors CCR-2
direkt mit dem Grad der Atherosklerose und der Makrophageninfiltration in die
Läsion verbunden (25).
_4. Diskussion _
In atherosklerotischen Arterien und dort besonders in makrophagenreichen
Gebieten der atherosklerotischen Läsion (77), findet sich außerdem ein
erhöhtes MCP-1 (77, 108).
Die proatherogene Wirkung des MCP-1 erstreckt sich sogar über das
Anfangsstadium hinaus (25, 32): es fördert nicht nur eine vaskuläre
Inflammation sondern fördert auch Plaqueprogression (25, 103), Plaqueruptur
(25, 103) und sogar Restenose nach Gefäßdilatation durch PTCA (32).
Monozytenaktivierung
Monozytenattachment und Monozytenrol ing an die MCP-1 sezernierende
Oberfläche (91, 112).
Versuche mit einer ischämischen MCP-1-Induktion am Herzmuskel und an
Koronargefäßen von Ratten zeigen eine MCP-1-mRNA-Expression und MCP-1-
Proteinproduktion sowohl in den Koronarien als auch im Inflammationsgebiet
des Herzmuskels. Außerdem zeigt sich Infiltration der Monozyten in diese
Inflammationsgebiete, aber keine veränderte Monozyteninfiltration in al e
anderen Organe, in denen auch keine veränderte MCP-1-Expression gefunden
wurde (114). Dies lässt auf eine lokalisierte Hochregulation des MCP-1 im
vaskulären Inflammationsgebiet schließen (114). Als Schlussfolgerung ergibt
sich, dass bei MCP-1 der Wirkort, was Monozytenattraktion angeht, identisch ist
mit seinem Produktionsort: MCP-1 selbst wirkt lokal (114). Eine in der
erwähnten Studie dennoch gefundene, systemische Verstärkung der
Atherosklerose geht auf die Ausschwemmung aktivierter, CD-11b-
exprimierender Makrophagen aus dem lokal begrenzten Inflammationsgebiet
hervor (114). Das Chemokin MCP-1 findet sich hochexprimiert in
makrophagenreichen Gebieten atherosklerotischer Läsionen im Tiermodel und
im Menschen (77, 81, 130). Es bedarf also einer lokalen MCP-1-
Überexpression direkt in der Gefäßwand um eine erhöhte Monozyteninfiltration
in diese Stel e hervorzurufen und dort eine Neointimabildung anzuregen (66,
_4. Diskussion _
Tierversuche an Hasen mit lokalem Gentransfer des MCP-1-Gens in die
Aortenwand zeigten, dass lokal am Endothel Adhäsionsmoleküle exprimiert
wurden, Monozyten in die Läsion einwanderten und es zu intrazel ulärer
Lipidanhäufung und zu Intimahyperplasie kam. Es entwickelte sich also eine
vol ständige frühatherosklerotische Läsion, die histologisch einem „fatty streak"
entsprach (77). Dazu waren neben dem Gentransfer al erdings eine kurze
hochcholesterinhaltige Diät nötig (77). Zusammen mit ihr kann die lokale
Expression von MCP-1 in der Gefäßwand die Bildung einer Atherosklerose
Die Monotzytenrekrutierung hängt neben der Aktivierung eines Molekül-Sets
auf Endothelzel en von einem Gradienten eines „Chemoattractants" ab (66).
Tierversuche an transgenen Mäusen mit Überexpression des Chemokins
N51/KC zeigen Infiltration der von ihm angelockten neutrophilen Granulozyten
bis an die Stel e der Chemokinexpression (66). Im atherosklerotischen Plaque
wird speziel MCP-1 hoch exprimiert (120, 132). Bei in vitro-Versuchen an
MCP-1-Ausschüttung
Monozytenadhädsion an die sezernierenden Zel en aus (31).
Der Chemokingradient besteht aber nur lokal an seinem Entstehungsort:
Studien zu einem weiteren Chemokin, dem Macrophage inflammatory protein-
1β (MIP-1β), das Chemotaxe und Adhäsion von T-Zel en vermittelt, kommen zu
folgenden Ergebnissen (113): Zytokine werden im Blutkreislauf schnel vom
Entstehungsort weggewaschen und liegen, um trotzdem wirken zu können, in
immobilisierter Form vor. MIP-1β bindet an Proteoglycane auf Endothelzel en
und übt in dieser Form seine physiologische Wirkung aus, Aktivierung der
Leukozyten zur Bindung der T-Zel en an Adhäsionsmoleküle (113).
Eine solche Wirkung in lokal gebundener Form wurde auch für IL-8 bereits
gefunden (113) und für andere Zytokine, darunter MCP-1, postuliert (82, 113).
Diese Ergebnisse legen nahe, dass die Endothelbindung pro-adhäsiver
Zytokine ein generel er Mechanismus ist (113). Da die Mitglieder verschiedener
Chemokinunterfamilien, darunter auch die CC-Familie, an negativ geladene
Proteoglycane binden, ist es möglich, dass sie dies auch an damit verwandten
_4. Diskussion _
Molekülen im Gefäß- und Parenchymgewebe tun und damit eher einen soliden
und gebundenen, als einen flüssigen Konzentrationsgradienten bilden (66).
Obwohl diese Erkenntnisse eine lokale Bindung von MCP-1 höchstens
vermuten lassen und nicht beweisen, so zeigen sie doch, dass ein lokaler
Konzentrationsgradient wie er zur Monozytenchemotaxe durch MCP-1 nötig ist,
im systemischen Blutkreislauf schnel verdünnt und mit der Blutströmung
ausgeschwemmt würde.
Es wird deutlich, dass MCP-1, um an vaskulärer Inflammation mitzuwirken,
lediglich lokaler Wirkung durch einen Konzentrationsgradienten bedarf und
systemische Effekte durch Molekülabgabe in den Blutkreislauf nicht
vergleichbar sind. Das im Kreislauf zirkulierende MCP-1, das aus dem Plaque
heraus ins Blut gelangt ist, trägt dort zur Monozytenchemotaxe in seine
Ursprungsläsion nicht mehr bei. Im Gegenteil: die Untersuchung transgener
Mäuse mit globaler Überexpression intakter MCP-1-Proteine ergab keine
Monozyteneinwanderung in die MCP-1-sezernierenden Organe. Der hohe
MCP-1-Spiegel im Plasma vermindert sogar die Monozyteninfiltration (91, 99).
Er macht zirkulierende Monozyten unfähig, auf lokal erhöhte MCP-1-Spiegel zu
reagieren (91, 99).
Dies könnte entweder durch Desensibilisierung der Rezeptoren auf Monozyten
geschehen oder die MCP-1-Produktion und -Sekretion der transgenen Tiere
erzeugt einen so hohen Plasmaspiegel des Chemokins, dass zirkulierende
Monozyten im Kreislauf durch Neutralisation lokaler Gradienten nicht mehr
reagieren können (99). Die dabei vorgefundene Plasmakonzentration lag im
Bereich derer, die in vitro Maxima der Monozytenchemotaxe hervorgerufen
hatten (99). Ähnliche Reaktionen sind auch von anderen Chemokinen wie zum
Beispiel dem IL-8 berichtet (45, 63, 105). Seine Überproduktion in transgenen
Mäusen oder die intervenöse Verabreichung des Interleukins verhinderte die
sonst problemlose Induktion einer örtlichen Neutrophilenakkumulation durch
lokale IL-8-Gabe (45, 63, 105).
_4. Diskussion _
Zur Auslösung einer Leukozyteninfiltration bedarf es demnach einer low-Level-
MCP-1-Expression in anatomisch abgeschlossenen Gebieten: die Chemokine
zeigen ihre chemoattraktive Wirkung, wenn sie lokal und in niedrigem Level
exprimiert werden (91, 99). Die systemische Gabe des Chemokins jedoch
antagonisiert diesen Effekt (91, 99).
Hieraus erklären sich eventuel die Ergebnisse der multiplen linearen
Regressionsanalyse für die IMT aus unseren Daten, nach der bei hoher
Plasmakonzentration des MCP-1 Effekte auftreten, die Atherosklerose zu
bremsen scheinen. Das MCP-1 im systemischen Blutkreislauf, das im hier
untersuchten Kol ektiv größtenteils aus dem Fettgewebe stammt, interferiert mit
dem, in der atherosklerotischen Läsion aufgebauten, lokalen MCP-1-Gradienten
und könnte hierüber die Monozytenmigration beeinträchtigen. Dies wiederum
macht sich in einer geringeren Intima-Media-Dicke bemerkbar.
Das Vorliegen großer Fettmasse bei Übergewicht ist dennoch als
proatherosklerotisch einzustufen, denn das Fettgewebe verfügt durchaus über
MCP-1-unabhängige, proartherogene Mechanismen, wie die von ihm
sezernierten, weiteren Adipokine. So löst zum Beispiel die TNF-α-Wirkung
Insulinresistenz aus, einen der Schlüsselmechanismen des metabolische
Syndroms (49) und damit zu weiteren kardiovaskulären Risikofaktoren, die al e
paral el den Atheroskleroseprozeß vorantreiben. Auch ihr Einfluss zeigte sich in
den unifaktoriel en Zusammenhängen der IMT zum Beispiel mit der
Insulinresistenz und dem systolischen Blutdruck.
Da für das Chemokin sowohl die Triglyceride als auch der Körperfettgehalt
unabhängige Einflussfaktoren darstel ten, ist von 2 verschieden MCP-1-Quel en
auszugehen, die dessen Konzentration im Blutplasma gemeinsam bestimmen:
die atherosklerotische Läsion und das Fettgewebe. Zu welchem Anteil jeder
einzelne davon den Plasmaspiegel beeinflusst, kann aus den vorliegenden
Daten nicht sicher geklärt werden.
_4. Diskussion _
Die Betrachtung des Probandenkol ektivs legt al erdings nahe, dass durch die
hohe Prävalenz von Übergewicht, durch Ausschlüsse zahlreicher,
kardiovaskulärer Risikofaktoren und das junge Durchschnittsalter der
Teilnehmer, der Einfluss des Fettgewebes auf die Chemokinkonzentration im
Plasma überwiegt. Das Ausmaß der Atherosklerose zeigt sich deutlich
eingeschränkt, denn der Mittelwert der IMT des Kol ektives (0,54 ± 0,11 cm)
dementsprechend begrenzten Atheroskleroseeinfluss auf die MCP-1-
Plasmaspiegel erwarten. Trotzdem ist dieser Einfluss in geringer Ausprägung
vorhanden, was die univariate, positive Korrelation zwischen MCP-1 und der
IMT erklären könnte. Dieser Chemokinanteil aus dem Subendothelialraum
könnte in diesem Kol ektiv hauptsächlich durch Triglyceride induziert worden
4.5 Leptin und MCP-1-Plasmaspiegel:
Ein weiteres, statistisches Model wurde erstel t, um anderweitige Einflüsse des
Fettgewebes auf den MCP-1-Plasmaspiegel über alternative Mechanismen als
die direkte MCP-1-Sekretion zu untersuchen.
Die Sekretion von Leptin aus Fettgewebe könnte dies darstel en, da Leptin die
MCP-1-Produktion der Gefäßwand beeinflussen könnte. Das Adipokin ist
teilweise in Studien assozi ert mit gestörter Gefäßfunktion, unabhängig von
metabolischen und inflammatorischen Störungen, wie sie mit Fettleibigkeit
einhergehen. Es wird daher als möglicher Mechanismus angesehen, wie
Körperfett nachteiligen Einfluss auf kardiovaskuläre Erkrankungen nehmen
kann (106). Seine Rol e wird bestätigt in ob/ob-Knock-out-Mäusen, die kein
Leptin bilden können und trotz Fettleibigkeit keine Atherosklerose entwickeln
Leptin ist ein Peptid, das Fettzel en in den Kreislauf sezernieren (21). Es
reguliert das Körpergewicht über Beeinflussung der Nahrungsaufnahme und
deren Verstoffwechselung (21, 127). Es hat außerdem eigene, MCP-1-
unabhängige, atherosklerosebegünstigende Wirkungen: seine hypothalamische
_4. Diskussion _
Wirkung erhöht den Symphatikotonus und vermittelt hierüber eine
Blutdruckerhöhung (21, 71). Über Rezeptoren an Endothel im peripheren
Gewebe (13, 71, 127) und glatten Gefäßmuskelzel en (21) stimuliert es in vitro
die Proliferation und Migration der glatten Gefäßmuskeln (21, 106). Leptin
beschleunigt auch Gefäßverkalkung (21), denn lange Leptingabe löst
Kalzifikation vaskulärer Zel en aus (71, 106). Hohes Leptin, wie es bei
Fettleibigkeit gefunden wird, kann somit nachteilige Effekte auf die
kardiovaskuläre Gesundheit ausüben (13, 21, 127).
Leptin induziert auch oxidativen Stress und aktiviert so die Transkription
redoxsensitiver Gene die an der Atherosklerose teilhaben, auch die des MCP-1
(21). Leptin stimuliert an Endothelzel en in in vitro eine erhöhte Sekretion von
MCP-1 durch die Induktion und Akkumulation reaktiver Sauerstoffspezies (83,
In einem Model , das zwar Körperfettgehalt aber nicht Leptin berücksichtigt,
könnte Fettgewebe die MCP-1-Plasmakonzentration beeinflussen, indem von
ihm sezerniertes Leptin in der Gefäßwand die Produktion und Sekretion von
MCP-1 induziert. Daher wurde Leptin in ein gesondertes MCP-1-Model
integriert, obwohl es einen starken Zusammenhang zu den ebenfal s im Model
berücksichtigten Messwerten für Körperfettgehalt zeigte.
Andere Produkte des Fettgewebes wie IL-6 oder TNF-α erreichten im von uns
untersuchten Kol ektiv bereits unifaktoriel nicht das nötige Signifikanzniveau
und kommen daher auch nicht als ähnlich gelagerte, unabhängige
Mechanismen der MCP-1-Induktion in Frage.
Auch in diesem statistischen Model ergab die multiple lineare
Regressionsanalyse erneut das Alter, die Plasmatriglyceridkonzentration und
den prozentualen Körperfettgehalt als einzige unabhängige Einflussfaktoren für
das MCP-1. Leptin stel t somit keinen eigenen, unabhängigen Einfluss auf die
Plasmakonzentration
_4. Diskussion _
Zusammenhang zwischen MCP-1 und Leptin ist am Menschen bereits
beschrieben worden (83).
Damit ist eine leptinvermittelte MCP-1-Induktion im Subendothelialraum, die
einen eigenständigen Fettgewebeeinfluss auf die MCP-1-Plasmakonzentration
vortäuschen könnte, unwahrscheinlich. Der beschriebene unabhängige
Zusammenhang zwischen Fettmasse und MCP-1 stel te keinen bloßen
surrogat-Parameter
Grundlagenstudien tatsächlich für eine eigenständige MCP-1-Produktion und
Sekretion aus dem Fettgewebe.
Dies könnte Folgen haben für Diagnostik und Verständnis der Pathophysiologie
der Atherosklerose: bisherige Erkenntnisse über die Rol e des MCP-1 und seine
Herkunft aus al en Zel en des Atheroms sprachen dafür, MCP-1 als
Plasmamesswert für menschliche Atherosklerose einzusetzen (25, 83). So
finden sich in longitudinalen Studien unter Berücksichtigung zahlreicher
Risikofaktoren Assoziationen zu Herzinfarkt und Tod al gemein (25). Al erdings
wurde dies bisher mit Vorbehalt gesehen, denn eine Überlappung der
Wertebereiche der MCP-1-Konzentrationen bei gesunden und kranken
Individuen, schränkte seine Anwendbarkeit als Surrogatparameter für
kardiovaskuläre Erkrankungen auf Patienten mit bereits bekannter KHK ein
(25). Außerdem war eine MCP-1-Synthese in Nicht-Atheromzel en nicht
auszuschließen (83). Dies hat sich hiermit bestätigt und bedeutet für MCP-1,
dass es nicht ohne weiteres als unabhängiger Marker für Atherosklerose
eingesetzt werden kann.
4.6 Widersprüchliche epidemiologische Daten schließen einen IMT-senkenden
Einfluss des MCP-1 nicht aus:
Die aktuel en epidemiologischen Daten zeigen widersprüchliche Ergebnisse
über den Zusammenhang zwischen MCP-1 und al en Stadien der
_4. Diskussion _
Hoogeveen et al. zeigten in ihrer Studie an Patienten mit subklinischer
Atherosklerose oder beginnender koronarer Herzkrankheit (KHK), dass
Patienten mit peripherer arteriel er Verschlußkrankheit (pAVK) signifikant
erhöhte MCP-1-Spiegel hatten (48). Sie konnten al erdings keine signifikante
MCP-1-Erhöhung bei KHK-Patienten finden. In einem anders aufgebauten
Analysemodel zeigt sich aber dennoch ein signifikant erhöhtes KHK-Risiko für
MCP-1-Erhöhungen pro SD (48).
Dies zeigt, dass der Zusammenhang zwischen der Gefäßerkrankung und dem
Chemokin nicht leicht nachzuweisen ist, was möglicherweise durch den
störenden Einfluss einer 2. MCP-1-Quel e, wie dem Fettgewebe, erfolgen
könnte. So zeigte sich auch bei Hoogeveen et al. ein signifikanter
Zusammenhang zwischen MCP-1-Spiegel und BMI. Außerdem wurde bei der
Patientengruppe mit ohnehin schwacher KHK ein signifikant erhöhter BMI
(P=0,002) und erhöhte WHR (P<0,001) im Vergleich zur gesunden
Kontrol gruppe nachgewiesen (48). Ein Unterschied, der sich zwischen den
pAVK-Patienten und deren Kontrol gruppe nicht fand (48). Bei Übergewichtigen
war die Verbindung zwischen MCP-1 und der Atherosklerose also schwerer
Studien an Patienten, die zum Ausschluss chronischer KHK vorgestel t wurden,
zeigten einen deutlichen, unabhängigen Zusammenhang zwischen MCP-1 und
dem Auftreten von KHK und auch einen signifikanten MCP-1-Anstieg mit
zunehmender Belastung der Patienten an kardiovaskulären Risikofaktoren (72).
Auch in dieser Studie zeigten sich bei einem großen Anteil von Patienten stark
erhöhte BMI-Werte, sodass eine zusätzliche Beeinflussung des MCP-1-
Plasmaspiegels durch erhöhte Fettmasse auch hier nicht auszuschließen ist.
Durch deutlich ausgeprägte Atherosklerose dürfte der Anteil des aus dem
Plaque sezernierten MCP-1 am Plasmaspiegel in dieser Population jedoch sehr
ausgeprägt sein, sodass damit ein erhöhter MCP-1-Spiegel bei angiographisch
gesicherter, chronischer KHK nachgewiesen werden konnte (72).
De Lemos et al. zeigten in einer longitudinalen Studie an Patienten mit akutem
Koronarsyndrom den negativen, prognostischen Einfluss einer starken MCP-1-
_4. Diskussion _
Erhöhung im Plasma (25). Er fand neben der Verbindung des MCP-1 zu vielen
klassischen, kardiovaskulären Risikofaktoren ein signifikant erhöhtes Auftreten
Beobachtungszeit bei Probanden mit MCP-1-Werten über der 75. Perzentile
(25). Bei dieser Studie handelt es sich um Probanden die durch ihr akutes
Koronarsyndrom bereits eine erheblich, atherosklerotische Belastung
aufweisen. Störende Einflüsse, wie Fett als weitere Chemokinquel e, treten
daher möglicherweise in den Hintergrund und die unabhängige Verbindung des
Chemokins zur Atherosklerose in Form des Herzinfarktes lässt sich gut
darstel en. Trotzdem findet sich auch hier die Assoziation von MCP-1 und BMI.
Viele Studien konnten hingegen keinen Zusammenhang zwischen dem
Chemokin und Atherosklerose in den unterschiedlichsten Patientengruppen
In einer populationsbasierten Querschnittstudie von Deo et al. erreichte MCP-1
in der multivariaten Analyse neben den traditionel en Risikofaktoren nicht das
Signifikanzniveau eines unabhängigen Einflussfaktors der koronaren
Gefäßverkalkung (26). Auch hier konnte der Autor weitere mögliche MCP-1-
Quel en mit störendem Einfluss nicht ausschließen. Dabei kommen sowohl
anderenorts lokalisierte, atherosklerotische Plaques in Frage aber auch das
Fettgewebe ist möglich. So zeigte sich auch in dieser Studie ein
Zusammenhang von MCP-1 zum BMI (P=0,01) entgegen unseren Daten aber
nicht zum prozentualen Körperfettanteil (26).
Die Longitudinalstudie von Piemonti et al. an einem Kol ektiv älterer, relativ
übergewichtiger Frauen fand zwar univariat die erhöhte KHK-Mortalität bei
erhöhtem MCP-1-Spiegel, konnte aber MCP-1 multivariat nicht als
unabhängigen negativ prognostischen Faktor für KHK-Mortalität verifizieren
(83). Obwohl sich hier keine Verbindung zwischen dem Chemokin und den
Übergewichtsmesswerten zeigte, könnte dieses Ergebnis bei dem hohen BMI-
Mittelwert der Population durch Fettgewebe als eine zweite MCP-1-Quel e mit
verursacht sein.
_4. Diskussion _
Haim et al. untersuchte den prognostischen Einfluss erhöhter MCP-1-Spiegel
auf die KHK-Mortalität an einem normalgewichtigen Kol ektiv mit chronischer
KHK, also an einer Gruppe mit geringem Fetteinfluss und großer
atherosklerotischer Belastung (43). Es ließ sich keine Risikozunahme für
künftige kardiovaskuläre Events durch erhöhte MCP-1-Spiegel messen (43).
An einer anderen Population mit angiograpisch bestätigter, chronischer KHK
zeigte sich sogar eine unabhängige, inverse Assoziation des MCP-1 zur KHK
(97). Auch in dieser Studie zeigte die Patientengruppe einen signifikant
erhöhten BMI im Vergleich zur Kontrol gruppe (97). Daher ist ein störender
Einfluss einer MCP-1-Sekretion aus dem Fettgewebe denkbar. Da in dieser
Studie der mittlere MCP-1-Plasmaspiegel extrem hoch liegt, könnte es sich hier,
wie in der von uns untersuchten Population, ebenfal s um eine Störung des
lokalen MCP-1-Gradienten durch systemisch erhöhte MCP-1-Spiegel handeln.
Betrachtet man bei der Auswertung der epidemiologischen Studien neben dem
Zusammenhang zwischen MCP-1 und Atherosklerose auch die Messwerte für
Übergewicht, kann man durchaus die Verbindung des Chemokins zur
chronisch-inflammatorischen Gefäßerkrankung finden. Wo dies nicht gelang,
finden sich dagegen immer Hinweise auf eine störende, zum Teil sogar
interferierende MCP-1-Sekretion aus dem Fettgewebe.
Auch bei uns fand sich unifaktoriel eine positive Korrelation zwischen MCP-1
und der IMT. Ein solcher Zusammenhang wurde am Menschen bereits
multifaktoriel berichtet und so gedeutet, dass die Proteine eines erhöhten MCP-
1-Plasmaspiegels aus dem Atherom stammen könnten (108). Damit lässt sich
auch an unserem Kol ektiv ein geringer Einfluss der Atherosklerose am MCP-1-
Plasmaspiegel vermuten. Er fiel jedoch so gering aus, dass er multifaltoriel dem
übermächtigen Fettgewebseinfluss unterliegt und seine proatherosklerotische
Wirkung nicht mehr messbar ist.
_4. Diskussion _
4.7 Weitere Einflüsse auf die IMT:
a) IMT steigt im Alter:
Der unabhängige Zusammenhang der IMT mit dem Alter, wie er von uns
gemessen wurde, wird durch zahlreiche andere Arbeiten bestätigt (68, 117).
Der Alterseinfluss ist an der untersuchten Stel e der Carotis bereits quantitativ
untersucht worden und verursacht eine Erhöhung der IMT um 0,01mm/Jahr
Genaue physiologische Sol werte für die IMT gibt es bisher nicht (68). Doch
lassen verschiedene Arbeiten an kleineren, relativ risikofaktorarmen
Populationen eine Abschätzung zu (68). Als vermeintlich gesunde Werte gelten
danach mit 45 ± 6,2 Jahren 0,548 ± 0,065 mm an der A. carotis communis (84),
mit 47 ± 7Jahren 0,56 ± 0,02 mm für die rechte beziehungsweise 0,58 ± 0,02
mm für die linke A. carotis communis (36). Andere Studien mit älteren
Kol ektiven von 52,8 ± 11,8 Jahren zeigten in diesem 0,72 ± 0,13 mm (124) und
mit 65,6 ± 3,9 Jahren eine mittlere IMT von 0,83 ± 0,15 mm der A. carotis
Mit dem Durchschnittsalter von 42 Jahren ± 12 Jahren liegt die IMT mit ihrem
Mittelwert von 0,54 mm ± 0,11 cm damit im wünschenswerten Bereich des
entsprechenden Alters. Eine gravierende, atherosklerotische Verdickung der
Gefäßwand liegt nicht vor. Dies entspricht den Auswahlkriterien der
Probandengruppe.
b) HDL-Cholesterin schützt vor IMT-Erhöhung:
Das Ergebnis, nach dem HDL auch außerhalb seiner Verbindung zu LDL
eigenständige, hemmende Effekte auf die Entstehung der Atherosklerose im
Menschen hat, wurde durch andere Arbeiten bestätigt (4, 94, 117). Die
Untersuchung einer Population mit niederem HDL- und normwertigen LDL- und
Trigylceridkonzentrationen zeigte dort eine hohe Prävalenz (> 84%) von
erhöhter mittlerer IMT, die aus mindestens 10 Messwerten al er
Carotisabschnitte errechnet wurde (125).
_4. Diskussion _
Epidemiologische Daten sprechen für hohes HDL als unabhängigen,
protektiven Faktor vor kardiovaskulären Erkrankungen (17).
HDL stoppt die Zel adhäsion und –migration von Monozyten am Endothel durch
Downregulation der Adhäsionsmoleküle VCAM-1, ICAM-1 und E-Selectin (4,
30) über die Unterbrechung der Signaltransduktion nach Rezeptorbindung der
induzierenden Zytokine (20). HDL wirkt in dieser Hinsicht also
anti nflammatorisch (30, 94) und greift in den Pathomechanismus der
Atherosklerose ein.
Bei Patienten mit koronarer Herzkrankheit ist ein defektes HDL gefunden
worden, dass die Oxidation von LDL nicht hemmen kann (78, 79). Im
metabolischen Syndrom ist unter anderen proatherogenen Faktoren die HDL-
Konzentration erniedrigt (30). Durch die Wirkung von IL-6 auf Hepatozyten und
deren Syntheseleistung, verliert HDL während der akuten-Phase-Reaktion
Proteinzusammensetzung (62). Damit verliert HDL in der akuten Phase-
Reaktion seine anti nflammatorischen Eigenschaften und bietet keinen Schutz
mehr vor Oxidation (62).
HDL zeigt also eigenständige, schützende Effekte vor Atherosklerose und IMT-
Erhöhung wie sie am vorliegenden Kol ektiv gefunden wurden.
c) IL-6 und Intima-Media-Dicke:
Unsere Analyse zeigte zwischen IMT und IL-6 mit P=0,0585 den Trend zu
einem unabhängigen Zusammenhang.
Das Interleukin könnte aus subendothelialer Inflammation stammen, aber auch
Indiz sein für eine weitere Reaktionskaskade in Form eines generalisierten,
subinflammatorischen Zustands, über den Fettgewebe die Atherosklerose
begünstigen könnte.
Eine Hauptquel e für IL-6 ist das Fettgewebe, das in vivo über 25% seiner
Plasmakonzentration produziert (7, 76). Über seine Sekretion stimuliert das
Interleukin in der Leber die CRP-Produktion und vermittelt eine subklinische
_4. Diskussion _
Inflammation (7, 76). Diese könnte zum kardiovaskulären Risiko fettleibiger
Individuen beitragen (19, 76).
Dies könnte geschehen, indem IL-6 andere inflammatorische Zytokine, wie das
TNF-α, hochreguliert: TNF-α induziert in Gefäßwandzel en neben der
Expression der Adhäsionsmoleküle VCAM-1 und ICAM-1 auch die MCP-1-
Produktion (69). Damit sorgt es sowohl über MCP-1, als auch unabhängig vom
Chemokin, für Monozytenadhäsion und Monozytenmigration (69). Diese MCP-
1-unabhängige Atherosklerosepromotion könnte den statistischen Trend
repräsentieren, der hier neben dem MCP-1-Einfluss im Model für IMT bestand
d) Studiendaten zu weitern kardiovaskulären Risikofaktoren:
Die mit dieser Arbeit am besten vergleichbare Studie stammt von Urbina et al.
(117): dort wurde an jungen, gesunden, asymptomatischen Erwachsenen
(mittleres Probandenalter 32 Jahre) die Einflüsse auf die IMT der A. carotis
communis untersucht und vergleichbare Stoffwechselfaktoren im statistischen
Model berücksichtigt. Es fand sich ein positiver Zusammenhang zwischen IMT
der A. carotis communis beziehungsweise des Bulbus und dem Alter. Für die
IMT in der A. carotis interna fand sich keine derartige Verbindung (117).
Das Probandengeschlecht und der BMI wurden als reine Confounder und nicht
als unabhängige Einflussfaktoren bewertet. (117)
Außerdem fanden sich bei Urbina et al. (117) und in anderen Arbeiten
Verbindungen zum systolischen Blutdruck (37, 111), dem LDL-Cholesterin (4)
und ein, bezüglich der IMT, protektiver Einfluss des HDL-Cholesterins (94, 111).
Die Unterschiede der Ergebnisse erklären sich zum Teil aus den
unterschiedlichen Ausschlusskriterien: während Urbina et al. keine
Einschränkungen durchführte (117), wurden von uns starke Hypertoniker
ausgeschlossen. Dies könnte den Zusammenhang zwischen Blutdruck und IMT
schwächen, sodass er hier nicht signifikant wird. Ähnlich könnten sich die
Ausschlusskriterien auch auf LDL-Cholesterin und seine Zusammenhänge
auswirken. Die hohe Prävalenz von Übergewicht in unserer Probandengruppe
_4. Diskussion _
mit der damit assozi erten, atherogenen Dyslipidämie, bei der LDL-Cholesterin
aber nur wenig beeinflusst wird, stärken außerdem den Einfluss anderer
Lipoproteine gegenüber dem LDL-Einfluss. MCP-1 wurde von Urbina et al.
leider nicht berücksichtigt.
4.8 Weitere Einflüsse auf den MCP-1-Plasmaspiegel:
a) Plasmatriglyceride induzieren in der Gefäßwand MCP-1-Produktion:
Es fand sich ein Zusammenhang des MCP-1 mit dem Plasmaspiegel der
Triglyceride. Auch dieser wurde in der Literatur bereits am Menschen
beschrieben (83, 70), blieb aber nicht unangefochten (46). Al erdings weist die
widersprechende Arbeit von Hernández et al. (46) die Schwäche auf, dass sie
zwar Triglyceride beurteilt, aber weder den prozentualen Körperfettgehalt noch
den BMI oder andere Messwerte für Übergewicht und Fettleibigkeit
berücksichtigt. Dies kann eine entscheidende Rol e spielen, denn in jener
Studie könnte der hohe Triglyceridspiegel lediglich Confounder einer
vorliegenden Fettleibigkeit mit eigenem atherogenen Einfluss auf MCP-1 sein.
Die unabhängige Assoziation zwischen Triglyceridkonzentration und MCP-1
könnte auf verschiedenen Mechanismen beruhen:
In vitro-Versuche an menschlichen Peritonealmakrophagen zeigen, dass
oxidiertes VLDL, als besonders triglyceridreiches Lipoprotein (31), eine MCP-1-
mRNA-Expression induzieren kann (120). Auch natives VLDL wirkt ebenfal s
induzierend, aber wesentlich schwächer als seine oxdierte Variante (120).
Dabei wirkt oxidiertes VLDL sogar stärker MCP-1-induzierend als oxidiertes
LDL (120). Nach der mRNA-Expression erhöht sich darauf hin auch die MCP-1-
Proteinsekretion der Zel en, was eine verstärkte Monozytenmigration auslöst
(120). Ähnliches fand sich in Kulturen von Endothelzel en aus Hasenaorten: hier
exprimierten die Zel en nach Kontakt mit oxidiertem und nativem VLDL MCP-1-
mRNA, wobei auch hier das oxidierte VLDL stärker wirkte als natives VLDL
(98). Auch in menschlichen Endothelzel en und glatten Gefäßmuskelzel en
wurde nach Behandlung mit oxidiertem VLDL MCP-1-mRNA exprimiert (31).
_4. Diskussion _
Des Weiteren zeigen Studien zur fokalen Glomerulumsklerose, einem renalen
Pendant zur vaskulären Atherosklerose, dass eine VLDL-Behandlung einer
Kultur von Mesangiumzel en der menschlichen Niere dort die MCP-1-
Gentranskription und als Folge dessen auch die MCP-1-Proteinfreisetzung
erhöht (31). Die anschließend verstärkt beobachtete Monozytenadhäsion an
den sezernierenden Mesangiumzel en konnte durch MCP-1-Antikörper
vol ständig blockiert werden (31).
Damit könnte VLDL und seine oxidierte Variante sowohl durch die Initiation der
Monozytenrekrutierung (31, 98) als auch bei der anschließenden, exzessiven
Lipidablagerung und Schaumzel bildung (31) für die Atherogenese eine wichtige
Rol e spielen (98).
Die Untersuchung auf den Signaltransduktionsmechanismus des VLDL in
Mesangiumzel en ergab, dass die reine Lipidkomponente die MCP-1-
induzierende Wirkung nur schwächer auslösen kann, als das vol ständige
Lipoprotein (31). Sie tut dies durch eine Aktivierung der Kalzium-abhängigen
Proteinkinase C (31). Da Erkenntnisse vorliegen über eine mögliche NF-κB-
Aktivierung durch Proteinkinase C, über NF-κB-Bindungsstel en am MCP-1-
Promotor (31) und damit eine mögliche NF-κB-Beteiligung an der MCP-1-
Expression, lässt sich die Hypothese über einen Transduktionspathway der
Proteinkinase C via NF-κB-Aktivierung zur Aktivierung der MCP-1-
Genexpression in Mesangiumzel en aufstel en (31).
Andere in vitro- und in vivo-Versuche zeigen, dass sowohl Triglyceride als auch
VLDL über eine Fettsäurefreisetzung aus VLDL NF-κB in Endothelzel en aus
menschlichen Umbilikalvenen aktivieren können, unabhängig von oxidativem
Stress (29, 70). Als Mechanismus kommt die durch Lipoproteinlipase
ausgelöste Freisetzung verschiedener Fettsäuren wie Ölsäure und
Linolensäure aus Triglyceriden in Frage, denen in vitro die NF-κB-Aktivierung
gelang (29). Das aktivierte NF-κB ist in atherosklerotischen Plaques präsent,
während nur wenig in gesunden Gefäßen gefunden wird (29).
_4. Diskussion _
IDL ist ein weiteres Lipoprotein, das die atherogene Wirkung der Triglyceride
bewirkt. Es erhöht unter anderem in vitro bei Endothelzel en menschlicher
MCP-1-mRNA-Expression
Proteinfreisetzung (70). Dabei zeigt das IDL aus dem Blutplasma von
Diabetikern eine signifikant höhere Wirksamkeit als jenes von gesunden
Individuen (70). Diese Wirksamkeit zeigt außerdem eine Korrelation zum HbA1c der Diabetiker (70). Dies spricht für die stärkere Wirksamkeit eines qualitativ
veränderten IDL-Partikels (70). Der Triglyceridspiegel ist mit der Fähigkeit des
IDL zur proatherogenen Zytokininduktion assozi ert, da der hohe
Triglyceridgehalt des Plasmas den quantitativen Nachschub des IDL darstel t
und so die IDL-Massenzunahme induziert (70).
Der exakte Mechanismus der Zytokininduktion an Endothelzel en menschlicher
Umbilikalvenen durch IDL ist noch nicht vol ständig bekannt (70). Als
Signalpathway der MCP-1-Induktion gilt die oxidative Aktivierung des NF-κB-
Transkriptionsfaktor durch bisher nicht identifizierte Komponenten des IDL (70).
Diese bisherigen Erkenntnisse und der von uns gemessene, unabhängige
Zusammenhang zwischen Triglyceriden und MCP-1 im Plasma spricht für die
Model e der Atherosklerosepathogenese, in denen triglyceridreiche Lipoproteine
die MCP-1-Synthese im Subendothelialraum atherosklerotischer Läsionen
induzieren können (120). Versuche mit lokaler Gabe von MCP-1 in den
Kolateralkreislauf der Femoralarterie zeigen keine Veränderungen an
Triglycerid-, VLDL-, Gesamtcholesterin-, LDL-Cholesterin- und HDL-
Cholesterinmesswerten (118). Dies ist Indiz für einen kausal gerichteten
Zusammenhang in dem Trigylceride das MCP-1 beeinflussen und nicht
b) MCP-1 steigt mit dem Probandenalter:
Die multiple lineare Regressionanalyse offenbarte zwischen MCP-1 und dem
Probandenalter einen unabhängigen Einfluss, wie er durch andere Arbeiten
über MCP-1 am Menschen bestätigt wird (25, 83).
_4. Diskussion _
4.9 Einschränkungen der Ergebnisse:
Die Erfahrung des Untersuchers stel t einen Einflussfaktor bei der Durchführung
und Auswertung jeder sonographischen Messungen dar, also auch die IMT-
Dies wurde durch Qualitätssicherungsmaßnahmen vermieden, im Rahmen
derer die Messgenauigkeit der messenden Person durch mindestens 30
überwachte Übungsmessungen in mehrtägigem Training und durchgehender
Kontrol e der erhobenen Messdaten und Bilder von erfahrenen Untersuchern
optimiert wurde.
Da vielen Probanden nur ungenaue Angaben über ihr ehemaliges
Rauchverhalten machen konnten, ließ sich die Gruppe der ehemaligen Raucher
ungenau erfassen. Dies ist aber ein Phänomen, mit dem al e Studien umgehen
müssen, die Rauchverhalten berücksichtigen. Um trotzdem vorhandene
Ungenauigkeiten zu reduzieren, wurden nur aktive Raucher als solche erfasst
und al e Exraucher als Nichtraucher klassifiziert. Damit sank der Raucheranteil
im Kol ektiv und die Einflüsse des Rauchens wurden eher unterschätzt.
Eine gewisse Ungenauigkeit der Zusammenhänge ergibt sich aus der hohen
intraindividuel en Schwankung der Triglyceridkonzentration im Plasma, die bei
nur einmaliger Messung nicht erfasst werden kann (3).
Diesem Risiko wird durch das Studienprotokol Rechnung getragen: es verlangt
eine Nüchternphase vor der Untersuchung von mindestens 8 Stunden für al e
Probanden. Da die größten Triglyceridschwankungen durch deren alimentäre
Aufnahme entstehen (28, 40), sind derartige, ernährungsbedingte
Schwankungen minimiert.
Des Weiteren wird über verschiedene Subtypen des Übergewichts berichtet,
welche in Studien, bei denen Komponenten des metabolischen Syndroms als
Ausschlusskriterien dienten, ein bestimmter Subtyp überrepräsentiert wird und
die Datenanalyse kompliziert (53). Da eine solche Selektion nicht
auszuschließen ist, wurde auf die Besonderheiten der Probandengruppe und
ihrer Messwerte ausführlich eingegangen und an kritischen Stel en mehrfach
auf sie verwiesen.
_4. Diskussion _
Eine Verfälschung der Messwerte des Blutplasmas durch lokale
Endothelverletzung bei der Blutabnahme ist unwahrscheinlich, aber wie bei
al en Studien die Blutwerte verwenden, nicht auszuschließen.
Der Studienaufbau als Querschnittsstudie kann lediglich Zusammenhänge
erfassen, aber keine Kausalitäten aufdecken. Da weitere, spätere Analysen der
longitudinal angelegten TULIP-Studie bereits geplant sind, werden diese über
kausale Zusammenhänge Auskunft geben können.
4.10 Übertragbarkeit der Ergebnisse:
Da Ein- und Ausschlusskriterien eine junge Probandengruppe mit Übergewicht
beziehungsweise erhöhtem Risiko für Diabetes betrafen, handelt es sich hier
um eine „non-population based"-Studie. Damit sind die Ergebnisse auch nur auf
diese Untergruppe und nicht auf die Gesamtbevölkerung übertragbar.
Dennoch zeigen die Daten einen Einfluss, der bei gleich welcher
Risikofaktorenkombination in Individuen immer in gewissem Ausmaß vorliegen
dürfte und der zur genaueren Erforschung Anlass gibt.
Inflammation und Präatherosklerose bei Insulinresistenz:
Bedeutung löslicher MCP-1-Spiegel
Einleitung: Die erhöhte kardiovaskuläre Morbidität bei metabolischem
Syndrom beruht im Wesentlichen auf atherosklerotischen Gefäßkomplikationen.
Ob hier die insulinresistenzassozi erte Dyslipoproteinämie, Veränderungen in
Glukosehomöostase
Hyperinsulinämie
inflammatorische
Mechanismen, neben der essentiel en Hypertonie, von Bedeutung sind, ist noch
nicht hinreichend geklärt.
Auf inflammatorischer Ebene wird einer gesteigerten endothelialen
Monozytenadhäsion und Immigration in den Subendothelialraum eine wichtige
Rol e in der Atherosklerosepathogenese zugesprochen. Hier scheint
insbesondere dem „monocyte-chemoattractant protein-1" (MCP-1) eine
Triggerfunktion zu zukommen. MCP-1 auf aktivierten Endothelzel en vermehrt
exprimiert, reguliert Adhäsion und insbesondere die transendotheliale
Diapedese von Monozyten und steuert damit inflammatorische Prozesse in der
Gefäßwand. Die Erforschung dieser Zusammenhänge, insbesondere die
Bedeutung löslicher MCP-1-Spiegel im Serum, könnte neue prädiktive sowie
therapeutische Ansätze zur Prävention atherosklerotischer Erkrankungen
hyperglykämiebedingten
Gefäßwandveränderungen untersuchten wir die Assoziation von MCP-1-
Spiegeln (mittels ELISA im Nüchternplasma) und Intima-Media-Dicke (mittels
hochauflösendem Ultraschal - 13 Mhz) in einem noch normoglykämischen
Probandenkol ektiv mit einem erhöhten Typ-2 Diabetesrisiko. Zusätzlich erfolgte
zur multifaktoriel en Analyse eine differenzierte Diagnostik auf etablierte
metabolische Variablen, wie oraler Glukosetoleranztest, Insulinbestimmung
(nüchtern und nach standardisierter Belastung) zur Ermittlung des
Insulinsensitivitätsindex (ISI nach Matsuda), Lipoproteinanalytik neben den
klassischen antropometrischen Faktoren wie BMI, waist-to-hip-Ratio (WHR),
Körperfettanalyse sowie CRP, TNF-α und Interleukin 6 als weitere
Inflammationsmarker.
Ergebnis: Die IMT zeigte eine signifikante Korrelation (nach Pearson) zum
Lebensalter, BMI, WHR, systolischer Blutdruck, Blutzucker, HbA1c, ISI, HDL-Cholesterin, IL-6 und MCP-1. Nicht signifikant in unserem Prädiabetikerkol ektiv
hingegen waren diastolischer Blutdruck, LDL-Cholesterin, Triglyceride, Leptin,
hsCRP und TNF-α. In der multifaktoriel en Analyse (multiple lineare Regression)
unter Einschluss der univariat signifikanten Variablen, waren lediglich Alter,
HDL-Cholesterin und MCP-1-Spiegel von relevanter Bedeutung. Hier zeigten
sich al erdings höhere MCP-1-Spiegel mit einer niedrigeren IMT assozi ert. Die
Betrachtung von welchen Faktoren die löslichen MCP-1-Spiegel primär
abhängen, zeigte das Lebensalter, die prozentuale Körperfettmasse und die
Serum-Triglyceride von signifikanter Bedeutung.
Das Ergebnis erhöhter MCP-1-Spiegel bei geringerer
Atherosklerosemanifestation (niedrige IMT) in dem untersuchten jungen
Prädiabetikerkol ektiv lässt eine eher vaskuloprotektive Bedeutung löslicher
MCP-1-Moleküle in dieser frühen Lebensphase vermuten. Der Gedanke die
Endothelaktivierung bei Insulinresistenz würde zu erhöhten löslichen MCP-1-
Spiegeln führen, die damit das Atheroskleroserisiko abschätzen lassen, ist also
nicht ohne weiteres durch die Daten zu unterstützen. Die Arbeit bestätigt
vielmehr, dass die löslichen MCP-1-Spiegel stark vom Lebensalter und von der
Körperfettmasse
Literaturhinweise,
Insulinresistenz) eine wesentliche Quel e von MCP-1 darstel en könnte. Die
genaue Bedeutung dieser MCP-1 Quel e für die periphere Gefäßstrombahn,
insbesondere unter dem Einfluss verschiedener Risikofaktorenprofile, ist noch
nicht hinreichend geklärt.
Als Hypothese könnte damit postuliert werden, dass die messbaren MCP-1-
Spiegel im Blut nicht das auf Endothelzel en atherosklerosegefährdeter
Gefäßregionen exprimierten MCP-1 widerspiegeln und damit nicht geeignet
sind, den lokalen Inflammationsprozeß am Endothel peripherer Gefäße
_Literaturliste _
Agewall, S.; Fagerberg,
Carotid Artery Wal Intima-
B.; Attvall, S.;
Media Thickness Is
Associated With Insulin-
Urbanavicius, V.;
Mediated Glucose Disposal
in Men at High and Low Coronary Risk.
Alberti, K.G.; Zimmet, P.; The metabolic syndrome-a
new worldwide definition
Asia Pacific Cohort
Serum Triglycerides as a
Studies Collaboration
Risk Factor for Cardiovascular Diseases in the Asia-Pacific Region
Baldassarre, D.; Amato,
Increased carotid artery
Arteriosclerosis, 22
M.; Pustina, L.; Tremoli,
intima-media thickness in
E.; Sirtori, C.; Calabresi, subjekts with primary
Vascular Biology
L.; Franceschini, G.
Balletshofer, B.; Rittig,
Endothelial dysfunction is
K.; Enderle, M.D.; Volk,
detectable in young
A.; Maerker, E.; Jacob,
normotensive first-degree
S.; Mathaei, S.; Rett, K.; relatives of subjects wih Typ Häring, H.-U.
II-Diabetes in association with insulin resistance.
Balletshofer, B.; Rittig,
Indikatoren einer
K.; Stock, J.; Häring, H.-
Atherosklerose: Erfassung der endothelialen Dysfunction mittels hochauflösendem Ultraschall.
Bastard, J.-P.; Jardel, C.; Elevated Levels of
Bruckert, E.; Blondy, P.;
Interleukin 6 Are Reduced in Clinical
Capeau, J.; Lavil e, M.;
Serum and Subcuraneous
Vidal, H.; Hainque, B.
Adipose Tissue of Obese
Women after Weight Loss
Biospace Co., Ltd.
Reliability! You can trust.
The precosion body
composition analyser InBody 3.0
"Portal" adipose tissue as a
Arteriosclerosis
generator of risk factors for cardiovascular disease and diabetes.
Bonetti, P.O.; Lerman,
Endothelial dysfunction: a
Atherosclerosis, 23
L.O.; Lerman, A.
marker of atherosclerotic
Vascular Biology
Boring, L.; Gosling, J.;
Impaired Monocyte Migration The Journal of
Chensue, S.W.; Kunkel,
and Reduced Type 1 (Th1)
S.L.; Farese, R.V.;
Cytokine Response in C-C
Broxmeyer, H.E.; Charo, Chemokine-Receptor 2 I.F.
Borkan, G.A.; Gerzof,
Assessment of abdominal fat American
S.G.; Robbins A.H.;
content by computed
Hults, D.E.; Silbert, C.K.; tomomgraphy.
Clinical Nutrition
_Literaturliste _
Bouloumié, A.; Marumo, Leptin induces oxidative
T.; Lafontan, M.; Busse,
stress in human endothelial
Bracco, D.; Thiébaud,
Segmental body composition Journal of
D.; Chioléro, R.; Landry, assessed by bioelectrical
M.; Burchhardt, P.;
impedance analysis and
Carantoni, M.; Abbassi,
Relationship Between Insulin Atheriosklerosis, 18
F.; Warmerdam, F.;
Resistance and Partially
Klebanov, M.; Wang, P.-
Oxiddized LDL Particles in
W.; Chen, Y.-D.I.; Ashar, Healthy, Nondiabetic
S.; Reaven, G.M.
Carr, D.B.; Utzschneider, Intra-Abdominal Fat Is a
K.M.; Hull, R.L.;
Major Determinant of the
Kodama, K.; Retzlaff,
National Cholesterol
B.M.; Brunzell, J.D.;
Education Programm Adult
Shofer, J.B.; Fish, B.E.;
Treatment Panel III Criteria
Knopp, R.H.; Kahn, S.E. for the Metabolic Syndrome
Chan, D.C.; Barrett,
Dyslipidemia in Visceral
H.P.R.; Watts, G.F.
Obesity Mechanisms,
Implications, and Therapy
Cardiovascular Drugs
Chen, X.-L.; Tummala,
Angiotensin II Induces
P.E.; Olbrych, M.T.;
Monocyte Chemoattractant
Alexander, R.W.;
Protein-1 Gene Expression
in Rat Vascular Smooth Muscle Cells
Christiansen, T.;
Monocyte chemoattractant
Richelsen, B.; Bruun,
protein-1 is produced in
isolated adipocytes,
assocaited with adiposity and reduced after weight loss in morbid obese subjects
Cockerill, G.W.; Rye, K.-
High-Density Lipoproteins
Arteriosclerosis, 15
A.; Gamble, J.R.; Vadas, Inhibit Cytokine-Induced
M.A.; Barter, P.J.
Expression of Endothelial
Vascular Biology
Cell Adhesion Molecules,
Cooke, J.P.; Oka, R.K.
Does Leptin Cause Vascular Circulation
Coretti, M.C.; Anderson, Guidelines for the ultrasound Journal of the
T.J.; Benjamin, E.J.;
assessment of endothelial-
dependent flow-mediated
vasodilation of the brachial
Deanfield, J.; Drexler, H.; Gerhard-Herman, M.; Herrington, D.; Vallance, P.; Vita, J.; Vogel, R.
_Literaturliste _
Cushing, S.D.; Berliner,
Minimal y modifies low
J.A.; Valente, A.J.;
density lipoprotein induces
Territo, M.C.; Navab, M.; monocyte chemotactic
Parhami, F.; Gerrity, R.;
protein 1 in human
endothelial cells and smooth
DeKeulenaer, G.W.;
Convergence of Redox-
Arteriosclerosis, 20
Ushio-Fukai, M.; Yin, Q.; Sensitive and Mitogen-
Chung, A.B.; Lyons,
Activated Protein Kinase
Vascular Biology
P.R.; Ishizaka, N.;
Signaling Pathways in
Rengarajan, K.; Taylor,
Tumor Necrosis Factor-α-
W.R.; Alexander, R.W.;
Mediated Monocyte
Griendling, K.K.
Chemoattractant Protein-1 Induction in Vascular Smooth Muscle Ceels
DeLemos, J.A.; Morrow, Association Between Plasma Circulation
D.A.; Sabatine, M.S.;
Levels of Monocyte
Murphy, S.A.; Gibson,
Chemoattractant Protein-1
C.M.; Antman, E.M.;
and Long-Term Clinical
McCabe, C.H.; Cannon,
Outcomes in Patients With
C.P.; Braunwald, E.
Acute Coronary Syndromes
Deo, R.; Khera, A.;
Association Among Plasma
McGuire, D.K.; Murphy,
Levels of Monocyte
S.A.; Neto, J.d.P.M.;
Chemoattractant Protein-1,
Morrow, D.A.; De
Traditional Cardiovascular
Risk Factors, and Subclinicla Atherosclerosis
Després, J.P.; Moorjani, Regional distribution of body Arteriosclerosis
S.; Lupien, P.J.; Lupien,
fat, plasma lipoproteins and
P.J.; Tremblay, A.;
cardiovascular disease.
Nadeau, A.; Bouchard, C.
Devroey, D.; De Swaef,
Correlations Between Lipid
N.; Coigniez, P.;
Levels and Age, Gender,
Vandevoorde, J.;
Glycemia, Obesity, Diabetes,
Kartounian, J.; Betz, W.
Dichtl, W.; Nilsson, L.;
Very Low-Density
Goncalves I.; Ares,
Lipoprotein Avtivates
M.P.S.; Banfi, C.; Calara, Nuclear Factor-κB in F.; Hamsten, A.; Erikson, Endothelial Cells P.; Nilsson J.
Eckardstein von, A.;
High density lipoproteins and Arteriosklerosis
Nofer, J.-R.; Assmann,
atherosclerosis. Role of
cholesterol efflux and
Vascular Biology
reverse cholesterol transport.
Edward, G.L.; Yaw, L.S.; Very low-density lipoprotein
stimulates the expression of International monocyte chemoattractant protein-1 in mesangial cells
Molecular Mechanisms
Mediating Inflammation in Vascular Disease Special Reference to Monocyte Chemoattractant Protein-1
_Literaturliste _
Executive Summary of The
Detection, Evaluation,
Third Report of The National American
and Treatment of High
Cholesterol Education
Blood Cholesterol in
Program (NCEP) Expert
Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III).
Expert Panel on the
Clinical Guidelines on the
Identifikation, Evaluation, Identifacation, Evaluation,
and Treatment of
and Treatment of
Clinical Nutrition
Overweight in Adults
Overweight and Obesity in Adults: Executive Summary
Feinstein, R.; Kanety, H.; Tumor necrosis factor-α
Papa, M.Z.; Lunenfeld,
suppresses insulin-induced
tyrosine phosphorylation of
insulin receptor and ist substrates.
Ferrara, L.A.; Mancini,
Early Changes of the Arterial Arteriosclerosis
M.; Celentano, A.;
Galderisi, M.; Iannuzzi,
Uncomplicated Primary
R.; Marotta, T.; Gaeta, I. Hypertensive Patients.
Fukumoto, M.; Shoji, T.; ; Antibodies against oxidized
Arteriosklerosis, 20
Emoto, M.; Kawagishi,
LDL and carotid arterial
intima-media thickness in a
Vascular Biology
healthy population.
Gerhardt, C.C.; Romero, Chemokines control fat
I.A.; Cancel o, R.;
accumulation and leptin
Camoin, L.; Strosberg,
secretion by cultured human Endocrinology
Greenberg, A.S.;
Identifying the links between European
obesity, insulin resistance
and beta-cell function:
potential role of adipocyte-
derived cytokines in the pathogenesis of type 2 diabetes.
Hypertriglyceridemia, Insulin American
Resistance, and the
Metabolic Syndrome
Gunn, M.D.; Nelken,
Monocyte Chemoattractant
N.A.; Laio, X.; Williams,
Protwin-1 Is Sufficient for the Immunology
Chemotaxis of Monocytes and Lymphocytes in Transgenic Mice but Requires an Additional Stimulus for Inflammatory Activation.
Haim, M.; Benderly, M.;
Elevated Serum Triglyceride Circulation
Brunner, D.; Behar, S.;
Level and Long-Term
Graff, E.; Reicher-Reiss, Mortality in Patients With H.; Goldbourt, U.
Coronary Heart Disease
Haim, M.; Tanne, D.;
Monocyte Chemoattractant
Boyko, V.; Reshef, T.;
Protein-1 and Recurrent
Goldbourt, U.; Battler, A.; Cardiovascular Events in
Mekori, Y.A.; Behar, S.
Patients with Stable Coronary Heart Disease
_Literaturliste _
Han, K.H.; Han, K.O.;
Expression of monocyte
Journal of Lipid
chemoattractant protein-1
Quenhenberger, O.
receptor CCR2 is increased in hypercholesterolemia: differential effects of plasma lipoproteins on monocyte function.
Hechtmann, D.H.;
Intravascular IL-8: inhibitor of The Journal of
Cybulsky, M.I.; Fuchs,
polymorphonuclear
H.J.; Baker, J.B.;
leukocyte accumulation at
sites of acute inflammation.
Hernández, C.; Lecube,
Effects of hypolipidemic
Medical Science 9(3)
A.; Barberá, G.; Chacón, treatment on serum markers Monitor P.; Lima, J.; Simó, R.
of vascular inflammation in dyslipidemic men
Hiltunen, T.P.; Luoma,
Expression of LDL Receptor, Circulation
J.S.; Nikkari, T.; Ylä-
VLDL Receptor, LDL
Receptor Protein, and Scavenger Receptor in Rabbit Atherosclerotic Lesions
Hoogeveen, R.C.;
Plasma MCP-1 Level and
Morrison, A.; Boerwinkle, risk für peripheral arterial E.; Miles, J.S.; Rhodes,
disease vand incident
C.E.; Sharret, A.R.;
coronary heart disease:
Ballantyne, C.M.
Atherosclerosis Risk in Communities study
Hotamisligil, G.S.
Inflammatory pathways and
Journal of Obesity
Ikewaki, K.; Tohayama,
Fenofibrate Effectively
J.-I.; Nakata, Y.;
Reduces Remnants, and
Wakikawa, T.; Kido, T.;
Small Dense LDL, and
Increases HDL Particle Number in Hypertriglyceridemic Men-A Nuclear Magnetic Resonance Study
Isomaa, B.; Almgren, P.; Cardiovascular morbidity
Tuomi, T.; Forsén B.;
and mortality associated with
Lahti, K.; Nissén, M.;
the metabolic syndrome.
Taskinen, M.-R.; Groop, L.
Jiang, Y.; Beller,
Monocyte Chemotactic
D.J.;Frendl, G.; Graves,
Protein-1 regulates
adhaesion molecule expression and cytokine production in human monocytes.
Karelis, A.D.; St-Pierre,
Metabolic and Body
D.H.; Conus, F.; Rabasi-
Composition Factors in
Lhoret, R.; Poehlman,
Subgroups of Obesity: What Endocrinology
Sticking to the point
The case of visceral fat:
argument for the defense
Clinical Investigation
Kragelund, C.; Omland,
A farewell to body-mass
Kullo, I.J.; Hensrud,
Comparison of Numbers of
D.D.; Al ison, T.G.
Circulating Blood Monocytes Journal of in Men Grouped by Body
Mass Index (<25, 25 to <30, ≥30)
_Literaturliste _
Kume, N.; Gimbrone,
Lysophosphatidylcholine
Transcriptionally Induces
Growth Factor Gene
expression in Cultured Human Endothelial Cells
Through the looking glass:
the diverse in vivo activities
Abdominal obesity and ist
metabolic complcations:
implications for the risk of ischeamic heart disease.
Lee, H.; Shi, W.;
Role for Peroxisome
Tontonoz, P.; Wang, S.;
Proliverator-Activated
Subbanagounder, G.;
Receptor α in Oxidized
Hedrick, C.C.; Hama, S.; Phospholipid-Induced Borromeo, C.; Evans,
Synthesis of Monocyte
R.M.; Berliner, J.A.;
Chemotactic Protein-1 and
Interleukin-8 by Endothelial Cells
Lenten van, B.J.;
High-Density Lipoprotein
Wagner, A.C.; Nayak,
Loses its Anti-Inflammatory
D.P.; Hama, S.; Navab,
Properties During Acute
M.; Fogelman, A.M.
Influenza A Infection.
Ley, K.; Baker, J.B.;
Intravenous interleukin-8
inhibits granulocyte
emigration from rabbit
Luscinskas, F.W.
mesenteric vessels without altering L-selectin expression or leukocyte rolling.
Li, C.-Y.; Tsai, C.-S.;
Dobutamin Inhibits Monocyte Anaesthesiologie 97
Chueh, S.-H.; Hsu, P.-
Chemoattractant Protein-1
C.; Wang, J.-Y.; Wong,
Production and Chemotaxis
C.-S.; Ho, S.-T.
in Human Monocytes.
Li, D.; Mehta, J.L.
Antisense to LOX-1 inhibits
oxidized LDL-mediated upregulation of MCP-1 and monocyte adhaesion to human coronary artery endothelial cells.
Lira, S.A.; Zalamea, P.;
Expression of the
Heinrich, J.N.; Fuentes,
Chemokine N51/KC in the
M.E.; Carrasco, D.;
Thymus and Epidermis of
Lewin, A.C.; Barton,
Transgenic Mice Results in
D.S.; Durham, S.; Bravo, Marked Infitration of a Single R.
Class of Inflammatory Cells.
Loskutoff, D.J.; Samad,
The Adipocyte and
Arteriosclerosis, 18
Hemostatic Balance in
Obesity Studies of PAI-1
Vascular Biology
Ludwig, M.; Petzinger-
Intima-Media-Dicke der
Ultraschall in der 24
Kruthoff v., A.; Buquoy,
Karotisarterien: Früher
V.M.; Stumpe, K.O.
Indikator für Arteriosklerose und therapeutischen Endpunkt.
Lyon, C.J.; Law, R.E.;
Minireview: Adiposity,
Inflammation, and Atherogenesis
_Literaturliste _
Maeno, Y.; Kashiwagi,
IDL can stimulate
A.; Nishio, Y.; Takahara, atherogenic gene expression Research and N.; Kikkawa, R.
in cultured human vascular
Clinical Practice
endothelial cells
Mark, A.L.; Sivitz, W.I.
Uncoupling Metabolism and
Arteriosclerosis, 22
Coupling Leptin to
Cardiovascular Disease
Vascular Biology
Elevated Monocyte
Abegunewardene, N.;
Chemoattractant Protein-1
Seul, M.; Vosseler, M.;
Serum Levels in Patients at
Horstick, G.; Buerke, M.; Risk for Coronary Artery Darius, H.; Lindemann,
Matsuda, M.; DeFronzo, Insulin sensitivity inidices
obtained from oral glucose tolerance testing. Comparison with the euglycemic clamp.
Purification and
Larsen,C.G.; DuBois, G.; characterisation of a novel
monocyte chemotactic and
activating factor produced by human myelomonocytic cell line.
McLaughlin, T.; Abbasi,
Use of Metabilc Markers To
F.; Cheal, K.; Chu, J.;
Identify Overweight
Internal Medicine
Lamendola, C.; Reaven, Indivduals Who Are Insulin G.
Miller, G.E.; Stetler, C.A.; Clincal Depression and
Inflammatory Risk Markers
Freedland, K.E.; Banks,
for Coronary Heart Disease
Namiki, M.; Kawashima, Local Overexpression of
Aerteriosklerosis 22
S.; Yamashita, T.; Ozaki, Monocyte Chemoattractant
M.; Hirase, T.; Ishida, T.; Protein-1 at Vessel Wal
Vascular Biology
Inoue, N.; Hirata, K.;
Induces Infiltration of
Macrophages and Formation
Morishita, R.; Kaneda,
of Atherosclerotic Lesion.
Y.; Yokoyama, M.
Synergism With Hypercholesterolemia
Navab, M.; Berliner, J.A.; HDL and the Inflammatory
Arteriosclerosis, 21
Subbanagounder, G.;
Response Induced by LDL-
Hama, S.; Lusis, A.J.;
Derived Oxidized
Vascular Biology
Castellani, L.W.; Reddy, Phospholipids S.; Shih, D.; Shi, W.; Watson, A.D.; van Lenten, B.J.; Vora, D.; Fogelman, A.M.
Navab, M.; Hama, S.Y.;
Normal high density
Journal of Lipid
Anantharamaiah,G.M.;
lipoprotein inhibits three
Hassan, K.; Hough,
steps in the formation of
G.P.; Watson, A.D.;
mildly oxidized low density
Reddy, S.T.; Sevanian,
lipoprotein: steps 2 and 3.
A.; Fonarow, G.C.; Fogelman, A.M.
_Literaturliste _
Navab, M.; Imes,
Monocyte transmigration
S.S.;Hama, S.Y.; Hough, induced by modifcation of
G.P.; Ross, L.A.; Bork,
low density lipoprotein in
R.W.; Valente, A.J.;
cocultures of human aortic
wall cells is due to induction
Drinkwater, D.C.; Laks,
of MCP-1 synthesis and
H.; Fogelman, A.M.
abolished by HDL.
Nelken, N.A.; Coughlin,
Monocyte Chemotactic
S.R.; Gordon, D.; Wilcox, Protein-1 in human
atheromatous plaques.
Peters, W.; Charo, I.F.
Involvement of chemokine
receptor 2 and ist ligand,
monocyte chemoattractant protein-1, in the development of atherosclerosis: lessons from knockout mice.
Piemonti, L.; Calori, G.;
Fasting Plasma Leptin,
Mercalli, A.; Lattuada,
Tumor Necrosis Factor-α
G.; Monti, P.; Garancini, Receptor 2, and Monocyte M.P.; Costantino, F.;
Chemoattracting Protein 1
Ruotolo, G.; Luzi, L.;
Concentration in a
Population of Glucose-Tolerant and Glucose-Intolerant Women
Poli, A.; Tremoli, E.;
Ultrasonographic
Colombo, A.; Sirtori, M.;
meassurement of the
Pignoli, P.; Paoletti, R.
common carotid artery wall thickness in hypercholesterolemic patients. A new model for the quantification anf follow-up of preclinical atherosclerosis in living human subjects.
Proudfoot, J.M.; Croft,
Angiotensin II Type 1
K.D.; Puddey, I.B.;
Receptor Antagonists Inhibit Pharmacology
Basal As Well As Low-
Densitiy Lipoprotein and
Stimulated Human Monocyte Chemoattractant Protein-1
Metabolic Syndrom
Pathophysiology and Implications for Management of Cardiovascular Disease
Role of insulin resistance in
Ridker, P.M.; Cook,
A Randomized Trial of Low-
N.R.; Lee, I.-M.; Gordon, Dose Apirin in the Primary
D.; Gaziano, J.M.;
Prevention of Cardiovscular
Disease in Women.
Hennekens, C.H.; Buring, J.E.
Ridker, P.M.; Cushman,
Inflammation, Aspirin, and
M.; Stampfer, M.J.;
the risk of cardiovascular
Tracy, R.P.; Hennekens, disease in apperently
_Literaturliste _
Ridker, P.M.; Wilson,
Should C-Reactive Protein
P.W.F.; Grundy, S.M.
Be Added to Metabolic Syndrome an to Assessment of Global Cardiovascular Risk?
Rollins, B.J.; Walz, A.;
Recombinant human MCP-
1/JE induces chemotaxis, calcium flux and respiratory burst in human monocytes.
Rong, J.X.; Berman,
Lysophosphatidylcholine
Arteriosclerosis, 22
J.W.; Taubman, M.B.;
Stimulates Monoyte
Chemoattractant Protein-1
Vascular Biology
Gene Expression in Rat Aortic Smooth Muscle Cells
Rong, J.X.; Li, J.; Reis,
Elevating High-Density
E.D.; Choudhury, R.P.;
Lipoprotein Cholesterol in
Dansky, H.M.; Elmalem, Apolipoprotein E-Deficient V.I.; Fallon, J.T.;
Mice Remodels Advanced
Breslow, J.L.; Fisher,
Atherosclerosis Lesions by
Decreasing Macrophage and Increasing Smooth Muscle Cell Content.
The pathogenesis of
atherosclerosis: a perspective for the 1990s.
Atherosklerosis-an
inflammatory disease.
Journal of Medicine
Rothenbacher, D.;
Differential Expression of
Arteriosclerosis, 26
Müller-Scholze, S.;
Chemokines, Risk of Stable
Herder, C.; Koenig, W.;
Coronary Heart Disease,
Vascular Biology
and Correlation with Established Cardiovascular Risk Markers
Ruan, Q.; Deng, Z.;
Very low density lipoprotein
Chinese Medical 109
and oxidized very low
density lipoprotein induce monocyte chemotactic protein 1 in rabbit aortic smooth muscle cells
Rutledge, B.J.; Rayburn, High Level Monocyte
H.; Rosenberg, R.;
Chemoattractant Protein-1
North, R.J.; Gladue,
Expression in Transgenic
R.P.; Corless, C.L.;
Mice Increases Their
Susceptibility to Intracellular Pathogens
100 Saely, C.H.; Koche, L.;
Adult Treatment Panel III
Schmid, F.; Marte, T.;
2001 but not International
Aczel, S.; Langer, P.;
Daibetes Federation 2005
Hoefele, G.; Drexel, H.
Criteria of the Metabolic Syndrome Predict Clinical Cardiovascular Events in Subjects Who Underwent Coronary Angiography
101 Sartipy P.; Loskutoff,
Monocyte chemoattractant
protein 1 in obesity and
insulin resistance
Academy of Science
102 Sato, E.; Simpson, K.L.;
Effects of reactive oxigen
Grisham, M.B.; Koyama, and nitrogen metabolites on
S.; Robbins, R.A.
MCP-1-induced monocyte
chemotactic activity in vitro
_Literaturliste _
103 Selzman, C.H.; Miller,
Monocyte chemotactic
S.A.; Zimmerman, M.A.; protein-1 directly induces
Gamboni-Robertson, F.; human vascular smooth
Harken, A.H.; Banerjee,
muscle proliferation
Heart Circulating
104 Shishehbor, M.H.;
Association of Triglyceride-
Hoogwerf, B.J.; Lauer,
to-HDL Cholesterol Ratio
With Heart Rate Recovery
105 Simonet, W.S.; Hughes, Long-term impairment of
T.M.; Nguyen, H.Q.;
neutrophil migration in mice
overexpressing human
Danilenko, D.M.;
106 Singal, A.; Farooqi, S.;
Influence of Leptin on
Cole, T.J.; O Rahilly, S.; Arterial Distensibility A Novel Fewtrell, M.; Kattenhorn, Link Between Obesity and M.; Lucas, A.; Deanfield, Cardiovascular Disease? J.
107 Steffens, S.; Mach, F.
Inflammation and
108 Störk, S.; Baumann, K.;
The eddect of 17β-estradiol
von Schacky, C.;
on MCP-1serum levels in
postmenopausal women
109 Suurküla, M.; Agewall,
Ultrasound Evaluation of
Arteriosclerosis
S.; Fagerberg, B.;
Wendelhag, I.; Widgren, Manifestations in the Carotid B.; Wikstrand, J.
Artery in High-Risk Hypertensive Patients.
110 Suzuki, H.; Kurihara, Y.; A role for macrophage
Takeya, M.; Kamada, N.; scavenger receptors in Kataoka, M.; Jishage, K.; atheroclerosis and Ueda, O.; Sakaguchi, H.; susceptibility to infection. Higashi, T.; Suzuki, T.; Takashima, Y.; Kawabe, Y.; Cynshi, O.; Wada, Y.; Doi, T.; Matsumoto, A.; Azuma, S.; Noda, T.; Toyoda, Y.; Itakura, H.; Yazaki, Y.; Hotiuchi, S.; Takahashi, K.; Kruijt, J.K.; Berkel van, T.J.C.; Steinbrecher, U.P.; Ishibashi, S.; Maeda, N.; Gordon, S.; Kodama, T.
111 Suzuki, M.; Shinozaki,
Insulin Resistance as an
K.; Kanazawa, A.; Hara, Independent Risk Factor for Y.; Hattori, Y.; Tsushima, Carotid Wall Thickening. M.; Harano, Y.
112 Takahashi, K.; Mizuarai, Adiposity Elevates Plasma
S.; Araki, H.; Mashiko,
MCP-1 Levels Leading to the Biological
S.; Ishihara, A.; Kantani, Increased CD11-b-positive
A.; Itadani, H.; Kotani, H. Monocytes in Mice
_Literaturliste _
113 Tanaka, Y.; Adams,
T-cell adhesion induced by
D.H.; Hubscher, S.;
Hirano, H.; Siebenlist,
cytokine MIP-1β
114 Tomita, H.; Egashira, K.; Inhibition of NO Synthesis
Arteriosclerosis, 18
Kubo-Inoue, M.; Usui,
Induces Inflammatory
M.; Koyanagi, M.;
Changes and Monocyte
Vascular Biology
Shimokawa, H.; Takeya, Chemoattractant Protein-1 M.; Yoshimura, T.;
Expression in Rat Hearts
115 Tsao, P.S.; Wang, B.-Y.; Nitric Oxide Regulates
Buitrago, R.; Shyy, J. Y.- Monocyte Chemotactic J.; Cooke, J.P.
116 Ulmer, H.-V.
in: "Ernährung"
des Menschen, Schmidt, Thews, Lang
117 Urbina, E.M.; Srinivasan, Impact of Multiple Coronary
S.R.; Tang, R.; Bond,
Risk Factors in Intima-Media Journal of
M.G.; Kieltyka, L.;
Thickness of Different
Segments of Carotid Artery in Healthy Young Adults (The Bongalusa Heart Study)
118 van Royen, N.; Hoefer,
I.; Böttinger, M.; Hua, J.; Chemoatrractant Protein-1
Grundmann, S.; Voskuil, Therapy Increases Collateral M.; Bode, C.; Schaper,
Artery Formation in
W.; Buschmann, I.; Piek, Apolipoprotein E-Deficient J.J.
Mice but Induces Systemic Monocyte CD11b Expression, Neointimal Formation, and Plaque Progression
119 Wajdenberg, B.L.
Subcutaneous and visceral
adipose tissue: their relation Review to the metabolic snydrom.
120 Wang, G.-P.; Deng, Z.-
Oxidized low density
D.; Ni, J.; Qu, Z.-L.
lipoprotein and very low density lipoprotein enhance expression of monocyte chemoattractant protein-1 in rabbit peritoneal exudate macrophages
121 Wang, P.-W.; Liou, C.-
Relative Impact of Low-
W.; Wang, S.-T.; Eng,
densitiy Lipoprotein-
H.-L.; Liu, R.-T.; Tung,
Cholesterol Concentration
S.-C.; Chien, W.-Y.; Lu,
and Insulin Resistance on
M.-C.; Hsieh, C.-.; Chen, Carotid Wall Thickening in C.-H.; Chen, J.-F.; Chu,
Nondiabetic, Normotensive
J.W.; Reaven, G.M.
122 Weber, K.S.C.; Nelson,
Expression of CCR-2 by
Atherosclerosis, 19
P.J.; Gröne, H.-J.;
endothelial cells: Impercation Thrombosis and
for MCP-1 mediated wound
Vascular Biology
injury repair and in vivo inflammatory activation of endothelium.
_Literaturliste _
123 Wendelhag, I.;
Ultrasound measurement of
wall thickness on carotid
Suurküla, M.; Berglund,
artery: fundamental
G.; Wikstrand, J.
prinicples and description of a computerized analysing system
124 Wendelhag, I.; Wiklund,
Arterial wall thickness in
O.; Wikstrand, J.
hypercholesterolemia- ultrasound meassurement of intima-media thickness in common carotid artery.
125 Wilt, T.J.; Rubins, H.B.;
Carotid atherosclerosis in
Robins, S.J.; Riley, W.A.; men with low levels of HDL Collins, D.; Elam, M.;
Rutan, G.; Anderson, J.W.
126 Wung, B.S.; Cheng, J.J.; No Modulates Monocyte
Arteriosclerosis, 21
Shyue, S.-K.; Wang, D.L. Chemotactic Protein-1
Expression in Endothelial
Vascular Biology
Cells Under Cyclic Strain
127 Yamagishi, S.-I.;
Leptin Induces Mitochondrial The Journal of
Edelstein, D.; Du, X.-L.;
Superoxide Produktion and
Kaneda, Y.; Guzmán,
Monocyte Chemoattractant
M.; Brownlee, M.
Protein-1 Expression in Aortic Endothelial Cells by Increasing Fatty Acid Oxidation via Protein Kinase A
128 Yamamoto, T.; Eckes,
Monocyte Chemoattractant
Protein-1 Enhances Gene
Hartmann, K.; Krieg, T.
Expression and Synthesis of Matrix Metalloproteinase-1 in Human Fibroblasts by an Autocrine Il-1α Loop
129 Yan, L.L.; Daviglus, M.L.; Midlife Body Mass Index and Journal of the
Liu, K.; Stamler, J.;
Hospitalisation and Mortality American
Wang, R.; Pirzada, A.;
Garside, D.B.; Dyer,
A.R.; van Horn, L.: Liao, Y.; Fries, J.F.; Greenland, P.
130 Ylä-Herttuala, S.; Lipton, Expression of monocyte
B.A.; Rosenfeld, M.A.;
chemoattractant protein 1 in the National
Särkioja, T.; Yoshimura, macrophage-rich areas of
T.; Leonard, E.J.;
human and rabbit
Witztum, J.L., Steinberg, atherosclerotic lesions D.
131 Yoshimura, T.; Leonard, Identification of high affinity
receptors for human
Monocyte Chemotactic Protein-1 on human monocytes.
_Literaturliste _
132 Yusuf, S.; Hawken, S.;
Obesity and the risk of
Ounpuu, S.; Bautista, L.; myocardial infarctation in Franzosi, M.G.;
27000 participants from 52
Commerford, P.; Lang,
countries: a case-control
C.C.; Rumboldt, Z.;
Onen, C.L.; Lisheng, L.; Tanomsup, S.; Wangai, P.Jr.; Razak, F.; Sharma, A.M.; Anand, S.S.; INTERHEART Study Investigators
133 Zachariae, C.O.C.;
Properties of human
monocyte chemotaxis and
Thompson, H.C.; Apella, activating factor (MCAF)
E.; Mantovani, A.;
purified from a human
Oppenheim, J.J.;
fibrosarkoma cell line.
134 Zeiher, A.M.; Fisslthaler, Nitric Oxide Modulates the
B.; Schray-Utz, B.;
Expression of Monocyte
Chemoattractant Protein 1 in Ciltured Human Endothelial Cells
135 Zhu, Z.; Zhu,S.; Zhu, J.;
Endothelial dysfunction in
Giet v.d., M.; Tepel, M.
cold induced hypertensive
Ich danke meiner Familie, meinem Vater mit seinem unermüdlichen Einsatz für
ein sorgloses Studium al er seiner Söhne und meinen beiden Brüdern Philipp
und Christof für ihre Unterstützung in al en Lebenslagen des Medizinstudiums
und weit darüber hinaus.
Ich danke meiner Mutter, die mir mit ihrer Lebenserfahrung und Ruhe in
schweren Situationen immer ein lieber Gesprächspartner ist und deren Rat ich
nie missen möchte. Ich danke Euch dafür.
Mein Dank gilt außerdem Prof. Dr. Häring und der Arbeitsgruppe von Dr.
Bal etshofer, Dr. Rittig und Dr. Stock, dass sie mir die Erstel ung meiner
Doktorarbeit ermöglichten und mir beim zeitaufwendigen Erlernen der dafür
notwendigen praktischen und theoretischen Fähigkeiten behilflich waren. Ihr
steter Einsatz, ihre Anregungen und ihre ständige Erreichbarkeit für al e Fragen
haben mir bei dieser Arbeit immer geholfen, den richtigen Weg zu finden.
Ich danke dem ganzen Team des TULIP-Labors und des Zentral abors der Uni
Tübingen für seine Unterstützung.
Herzlich bedanken möchte ich mich auch bei al en meinen Freunden,
Kommilitonen und Familienmitgliedern, die sich für meine zahl osen
sonographischen Übungsmessungen als Probanden zu Verfügung gestel t
haben. Ganz besonders verdient haben ihn meine Mutter und meine Tante
Gisela Paulus, die beide in langen Reihenmessungen am Ultraschal viel
Geduld bewiesen haben und Franziska Ulsamer, die mit ihrer unkomplizierten
terminlichen Flexibilität oft in die Bresche springen musste.
Ein speziel er Dank geht an meinen Statistiker Dr. Gunnar Blumenstock, der bei
einer verzwickten Datenlage nicht nur viel Zeit und Mühe investiert hat, sondern
neben seinem fachlichen auch sein didaktisches Können unter Beweis gestel t
hat. Sie sind mir eine große Hilfe gewesen und ich habe bei Ihnen viel lernen
Ich danke auch Lothar, Cordula, Irene und Bernadette Ulsamer. Durch viele
große und kleine Hilfen im oft turbulenten Al tag um meine Doktorarbeit herum
haben sie immer den stetigen Fortschritt dieser Arbeit unterstütz und sich dabei
oft als ruhender Pol entpuppt.
Mein ganz besonderer Dank gilt meiner Verlobten Franziska Ulsamer. In einem
so arbeitsintensiven Studium, wie Medizin, musste sie oft genug unsere
gemeinsamen und ihre eigenen Interessen hinten anstel en. Durch ihr
ständiges Bemühen um unsere gemeinsame Zukunft, ihre ansteckend gute
Laune und ihre unerschöpfliche Geduld mit mir hat sie mehr als jeder andere zu
dieser Arbeit beigetragen. Ohne meine (definitiv) bessere Hälfte, die mir immer
den Rücken freigehalten hat, sogar als sie selbst von Prüfungen, Verletzung
und Operation stark angeschlagen war, wäre mir diese Arbeit oft über den Kopf
gewachsen. Ich danke Dir für Deinen Beistand in einer turbulenten Zeit und ich
freue mich darauf, auch die ruhigeren Zeiten mit Dir genießen zu können.
Name: Björn Kocher
Geburtstag: 29.04.1977
Familienstand: ledig
Konfession: evangelisch
Eltern: Kurt Kocher (Zahnarzt) und Ingrid Kocher, geb. Höhn (Lehrerin)
Geboren in Tübingen
Schulabschluss mit Abitur
September 1997-September 1998:
Zivildienst im Rettungsdienst des
Deutschen Roten Kreuzes im
Kreisverband Tübingen. Anschließend
fortgesetzt als ehrenamtliche Tätigkeit
Oktober 1999-September 1999:
2 Semester Jurastudium in Tübingen
Beginn des Medizinstudiums in
12.-13. März 2002:
Physikum in Tübingen bestanden
22. Juli-25. August 2002:
Famulatur in der Medizinischen Klinik
Tübingen auf dem Gebiet Innere
24.-25. März 2003:
1. Staatsexamen in Tübingen
Beginn meiner Dissertation auf dem
Gebiet der Angiologie
15. September-28. September 2003:
Famulatur in einer
al gemeinmedizinischen Hausarztpraxis
16. Februar-14. März 2004:
Famulatur am Klinikum Garmisch-
Partenkirchen auf dem Gebiet der
15. März-16. April 2004:
Famulatur in einer radiologischen
Praxis in Sindelfingen.
31. August-3. September 2004:
Posterpräsentation der Doktorarbeit auf
der 13. Jahrestagung der Deutschen
Gesel schaft für Angiologie in Wien.
28. Februar-16. März 2005
Famulatur in einer Kinderarztpraxis in
8. September 2005
2. Staatsexamen in Tübingen
Oktober 2005- November 2006
Praktischen Jahres im städtischen
Krankenhaus Sindelfingen, Wahlfach
15. und 16. November 2006
3. Staatsexamen in Tübingen
Ab 15. Dezember 2006
Assistenzarzt in der Orthopädie des
Krankenhaus Sindelfingen
Source: http://www.b4bh.ch/userfiles/Accuracy_KocherTUE_170607_pdf.pdf
Beth Jacob's Vol. 26 - No. 2 february, march 2010 adar, NisaN 5770 Dates To Remember PURIM @BETH JACOB Saturday & Sunday, February 27 & 28 Special Purim Celebration for Young Children including Costume Parade & entertainment at 6:00 pm on Saturday, February 27. Mincha and Ma'ariv at 6:30 pm imme- diately followed by the reading
Hamilton Elementary School Student Handbook 2016-2017 It's All About the Learning Ph: 816-583-4811 Fax: 816-583-7919 School Hours: 8:00-3:00 Office Hours: 7:30-4:30 HAMILTON R-II SCHOOL DISTRICT School Calendar 2016-2017 New Staff In-Service All Staff In-Service First Day of School-Early Dismissal 1:00




